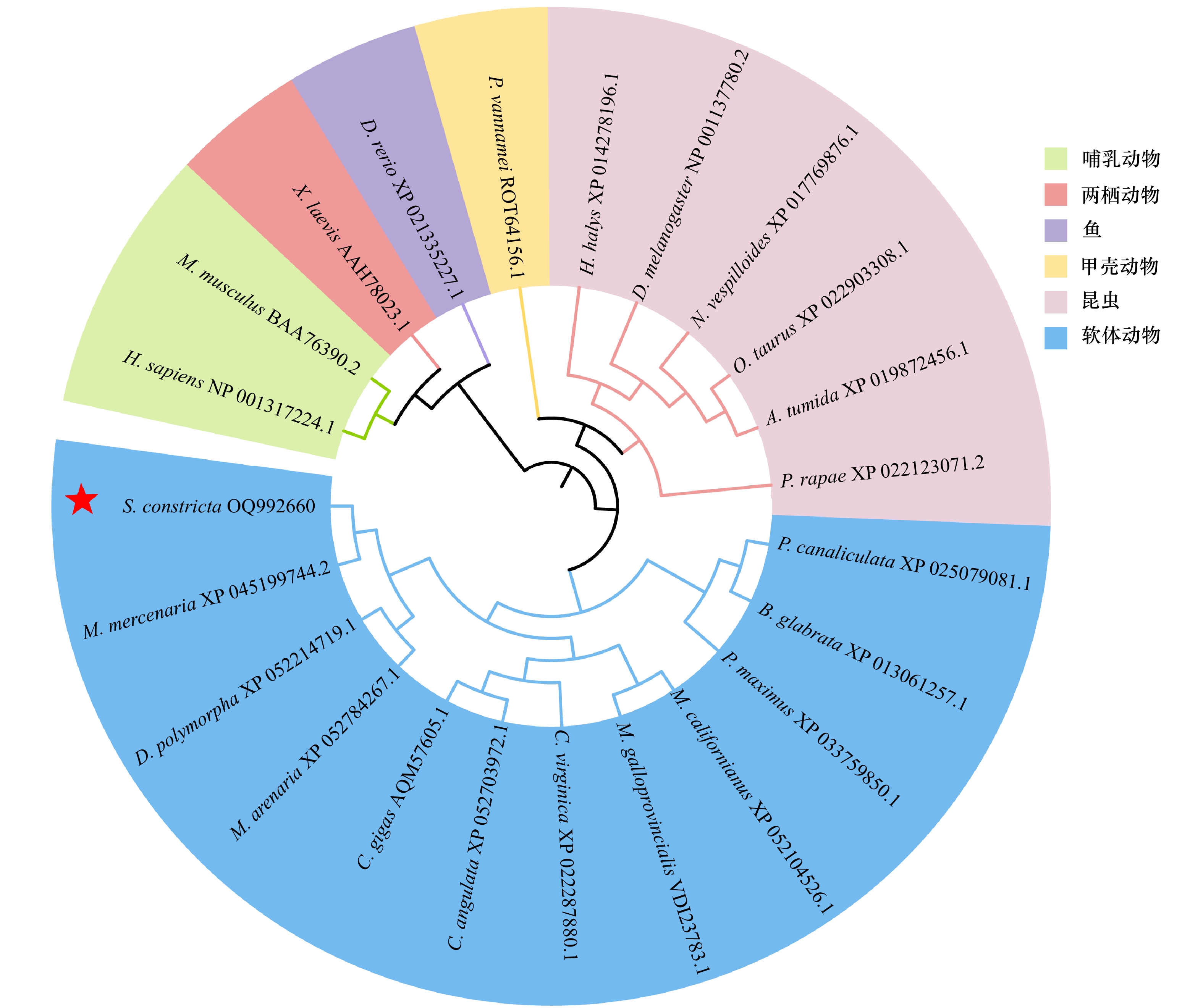
Identification and circadian expression patterns of circadian clock gene Tim and its effects on sex hormone secretion in Sinonovacula constricta
-
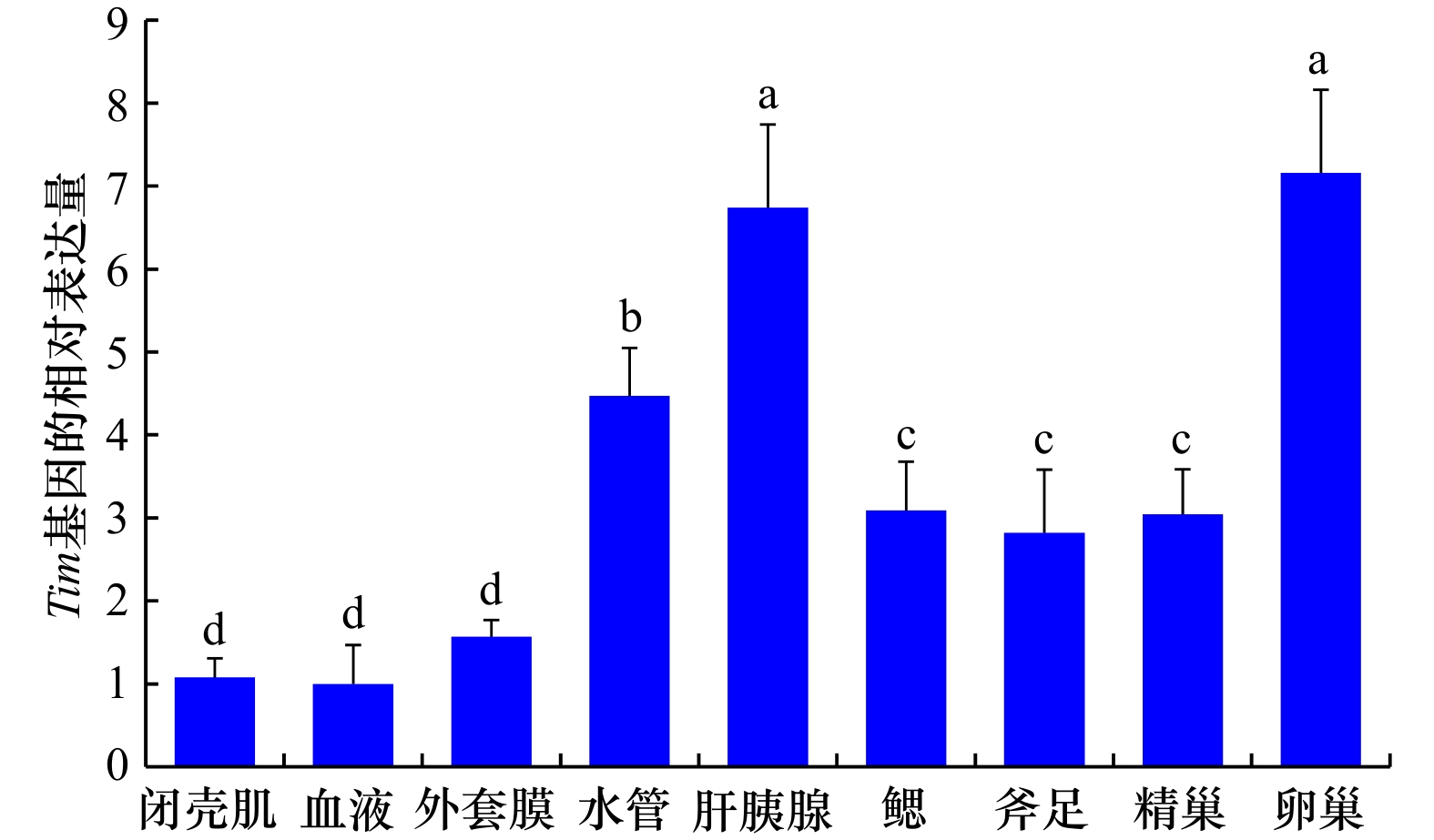
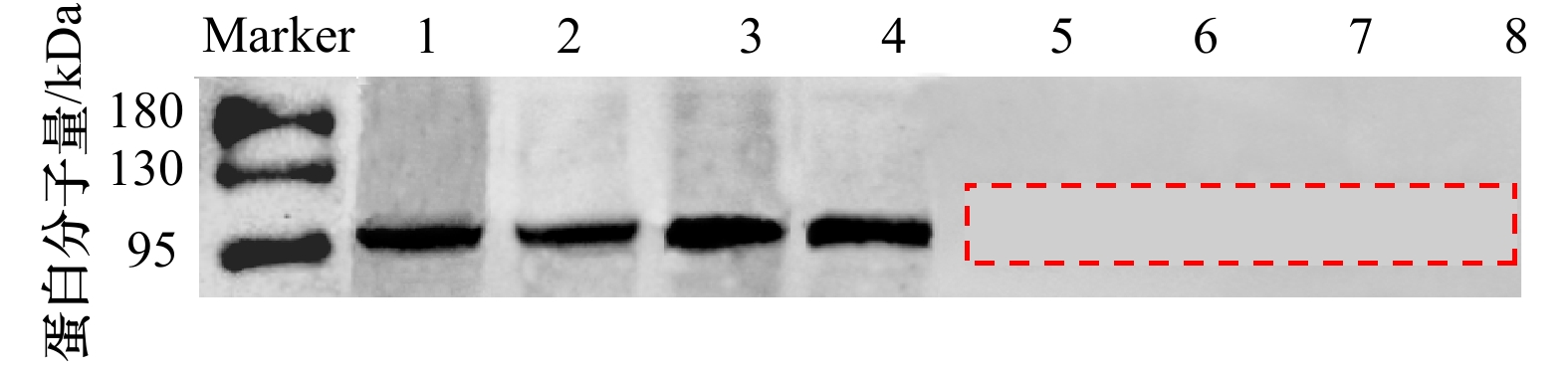
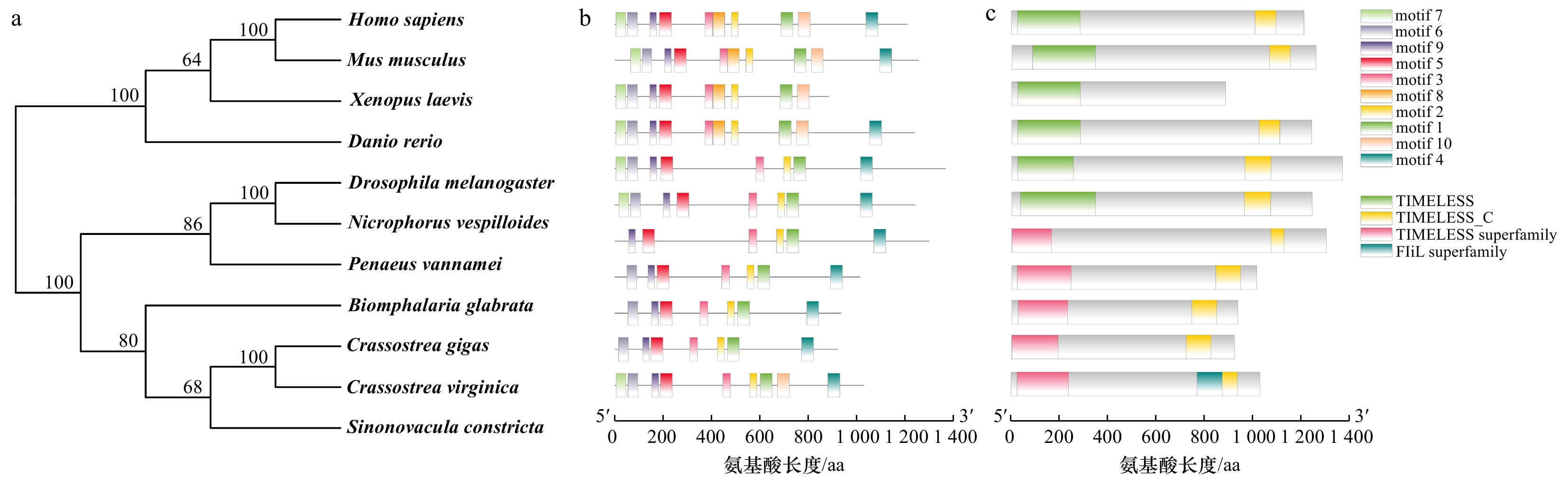
摘要: Tim(Timeless)是继Per基因发现后的第2个核心生物钟基因,在动物繁殖调控中发挥重要作用。为探讨生物钟基因Tim对缢蛏夜间产卵的调控作用,本研究克隆了缢蛏Tim基因的cDNA全长序列并进行序列分析,利用qRT-PCR和免疫荧光技术研究了Tim基因/蛋白在不同组织中的昼夜表达模式,并用siRNA干扰技术初步研究了Tim基因对性激素分泌的影响。结果显示,缢蛏Tim基因开放阅读框序列为3 090 bp,编码1 029个氨基酸,具备3个保守结构域(TIMELESS superfamily、TIMELESS_C和FIil);Tim基因在缢蛏各个组织中均有表达,其中在肝胰腺、水管、卵巢、精巢中的表达水平较高;Tim基因在卵巢和精巢中呈现昼夜规律性表达,均在白天12:00–18:00较高,夜间00:00–06:00较低;Tim蛋白主要定位在肝胰腺的肝细胞、水管末端的上皮细胞、卵巢的成熟卵母细胞及精巢的精子细胞中,且在卵巢和精巢中的阳性信号均是白天12:00稍强于夜间00:00;siRNA干扰后,Tim基因在精巢、卵巢中的表达量均在干扰后第3~7 天显著下降(P < 0.05),而精巢中睾酮和卵巢中雌二醇含量均在干扰后第1~9 天极显著下降(P < 0.01)。由此可见,Tim基因/蛋白在精巢和卵巢中的表达均呈昼夜规律性变化,并且其被干扰后性激素含量显著降低,推测Tim基因可能通过介导性激素的分泌进而调控缢蛏夜间产卵过程。本研究初步探讨了缢蛏生物钟基因Tim的昼夜表达模式及其对性激素分泌的影响,将对深入解析贝类产卵机制和优化工厂化育苗技术具有重要应用价值。Abstract: Tim (Timeless) is the second core circadian clock gene identified after the discovery of Per, which plays an important role in the regulation of animal reproduction. In order to explore the molecular mechanisms of Tim to regulate spawning in Sinonovacula constricta, the cDNA sequence of Tim was cloned and analyzed, the circadian expression patterns of Tim gene/protein in different tissues were analyzed by qRT-PCR and immunofluorescence technology, and the regulatory effects of Tim on sex hormone secretion were investigated by siRNA technology. The ORF sequence of Tim was 3 090 bp, encoding 1 029 amino acids and containing three conserved domains (TIMELESS superfamily、TIMELESS_C and FIil). Tim was expressed in test tissues, and showed higher expression levels in the hepatopancreas, siphon, ovary and testis. The expression levels of Tim were higher at 12:00–18:00 in the daytime and lower at 00:00–06:00 in the night time, which exhibited circadian rhythmic expression patterns in the ovary and testis. Tim protein was mainly expressed in hepatocytes of the hepatopancreas, epithelial cells of siphons, mature oocytes of the ovary, and spermatids of the testis. And protein fluorescence signals of Tim were slightly stronger at 12:00 during the day than at 00:00 during the night in the ovary and testis. After siRNA injection, the expression levels of Tim significantly decreased from the 3rd to 7th day in the siRNA treatment groups of the ovary and testis (P < 0.05). Meanwhile, the contents of testosterone in the testis and estradiol in the ovary decreased significantly from the 1st to 9th day after siRNA injection (P < 0.01). Consequently, it could be concluded that Tim gene/protein exhibited circadian rhythmic expression patterns in the ovary and testis, and the contents of sex hormones significantly decreased after Tim interference, which suggested that Tim might regulate the nocturnal spawning by mediating the secretion of sex hormones in S. constricta. These findings preliminarily explored the regulatory effects of circadian clock gene Tim on nocturnal spawning of S. constricta, which will provide important application value for in-depth analysis of spawning mechanism and optimizing industrialized seedling breeding technology in mollusks.
-
Key words:
- Sinonovacula constricta /
- circadian clock /
- Tim /
- gene expression /
- siRNA /
- sex hormone
-
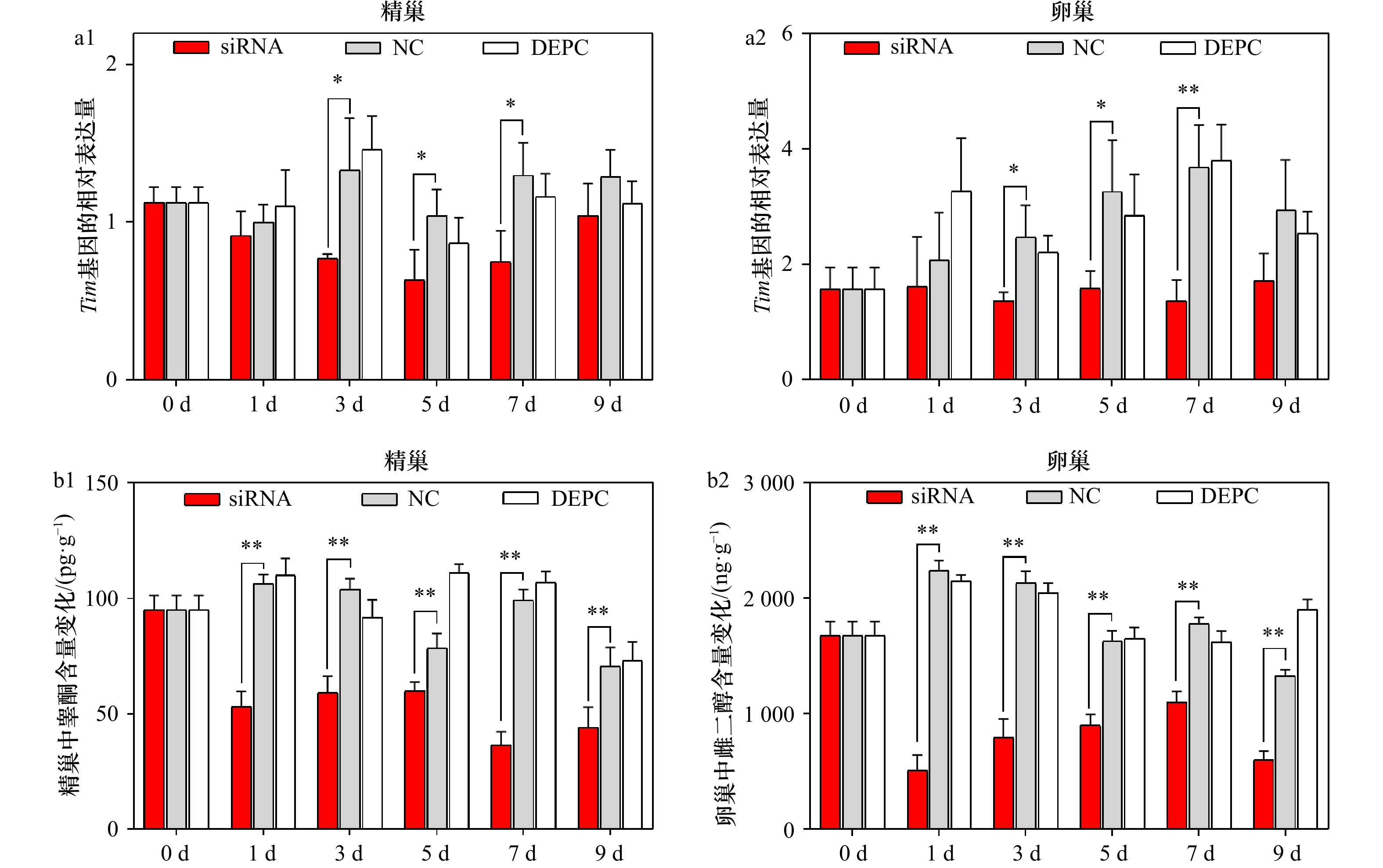
图 7 siRNA注射后Tim基因表达及睾酮和雌二醇含量变化(n = 6)
a1,a2:siRNA干扰后Tim基因在精巢和卵巢中的表达变化;b1,b2:siRNA干扰后精巢中睾酮和卵巢中雌二醇的含量变化;*代表P < 0.05;**代表P < 0.01
Fig. 7 Gene expression of Tim and testosterone and estradiol contents after siRNA injection (n = 6)
a1, a2: Relative expressions of Tim in testis and ovary among groups after siRNA injection; b1, b2: the testosterone (testis) and estradiol (ovary) content changes among groups after siRNA injection; * represents P < 0.05, and ** represents P < 0.01
表 1 实验所用引物序列信息
Tab. 1 Information of primers used in the experiments
引物名称 引物序列(5′-3′) 用途 RACE- Tim-5 CCATAGACCTTTGTCGGCGAGTTGCTGT 基因克隆 RACE- Tim-3 TGGCGACACCTACTTCAGGGCTTTTATT 基因克隆 Tim-F1 GTAATGAACGGAATGGGGCT 序列验证 Tim-R1 ATGGGGCTAAATGGAAGTCTCA 序列验证 Tim-F2 GGAACACCTACTGGATGACGAC 序列验证 Tim-R2 TGTTATGGCTGGTGGCAATG 序列验证 Tim-F3 AATCAACTTTTCAAGGGGACG 序列验证 Tim-R3 GTCTTCTCTTTGATTGATGTCGTG 序列验证 Real-Tim-F CGGAATGGGGCTAAATGG 荧光定量 Real-Tim-R CGTCATCCAGTAGGTGTTCCA 荧光定量 18S rRNA-F TCGGTTCTATTGCGTTGGTTTT 荧光定量 18S rRNA-R CAGTTGGCATCGTTTATGGTCA 荧光定量 siRNA-Tim-F GGAAGGAAAUAGAGUUUAATT siRNA干扰 siRNA-Tim-R UUAAACUCUAUUUCCUUCCTT siRNA干扰 NC-F UUCUCCGAACGUGUCACGUTT siRNA干扰 NC-R ACGUGACACGUUCGGAGAATT siRNA干扰 -
[1] Fustin J M, Doi M, Yamaguchi Y, et al. RNA-methylation-dependent RNA processing controls the speed of the circadian clock[J]. Cell, 2013, 155(4): 793−806 [2] Miller B H, Takahashi J S. Central circadian control of female reproductive function[J]. Frontiers in Endocrinology, 2013, 4: 195. [3] Miller B H, Olson S L, Turek F W, et al. Circadian clock mutation disrupts estrous cyclicity and maintenance of pregnancy[J]. Current Biology, 2004, 14(15): 1367−1373. doi: 10.1016/j.cub.2004.07.055 [4] Nakao N, Yasuo S, Nishimura A, et al. Circadian clock gene regulation of steroidogenic acute regulatory protein gene expression in preovulatory ovarian follicles[J]. Endocrinology, 2007, 148(7): 3031−3038. doi: 10.1210/en.2007-0044 [5] Huang Jian, Zhong Zhaomin, Wang Mingyong, et al. Circadian modulation of dopamine levels and dopaminergic neuron development contributes to attention deficiency and hyperactive behavior[J]. The Journal of Neuroscience, 2015, 35(6): 2572−2587. doi: 10.1523/JNEUROSCI.2551-14.2015 [6] Ulgherait M, Chen Anna, Oliva M K, et al. Dietary restriction extends the lifespan of circadian mutants tim and per[J]. Cell Metabolism, 2016, 24(6): 763−764. doi: 10.1016/j.cmet.2016.11.002 [7] Boden M J, Varcoe T J, Kennaway D J. Circadian regulation of reproduction: from gamete to offspring[J]. Progress in Biophysics and Molecular Biology, 2013, 113(3): 387−397. doi: 10.1016/j.pbiomolbio.2013.01.003 [8] Beaver L M, Gvakharia B O, Vollintine T S, et al. Loss of circadian clock function decreases reproductive fitness in males of Drosophila melanogaster[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(4): 2134−2139. [9] Beaver L M, Rush B L, Gvakharia B O, et al. Noncircadian regulation and function of clock genes period and timeless in oogenesis of Drosophila melanogaster[J]. Journal of Biological Rhythms, 2003, 18(6): 463−472. doi: 10.1177/0748730403259108 [10] Tobback J, Boerjan B, Vandersmissen H P, et al. Male reproduction is affected by RNA interference of period and timeless in the desert locust Schistocerca gregaria[J]. Insect Biochemistry and Molecular Biology, 2012, 42(2): 109−115. doi: 10.1016/j.ibmb.2011.11.003 [11] Chen Suhua, Qiao Hui, Fu Hongtuo, et al. Molecular cloning, characterization, and temporal expression of the clock genes period and timeless in the oriental river prawn Macrobrachium nipponense during female reproductive development[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2017, 207: 43−51. [12] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022.Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2022. [13] 王如才, 王昭萍, 张建中. 海水贝类养殖学[M]. 青岛: 中国海洋大学出版社, 2008.Wang Rucai, Wang Zhaoping, Zhang Jianzhong. Science of Marine Shellfish Culture[M]. Qingdao: China Ocean University Press, 2008. [14] 吴洪喜, 徐爱光. 缢蛏人工育苗试验[J]. 海洋科学, 2000, 24(2): 15−17. doi: 10.3969/j.issn.1000-3096.2000.02.006Wu Hongxi, Xu Aiguang. A test of artificial cultivation of Sinonovacula constricta[J]. Marine Sciences, 2000, 24(2): 15−17. doi: 10.3969/j.issn.1000-3096.2000.02.006 [15] 徐义平. 关于缢蛏的养殖技术之二缢蛏生产性人工育苗技术总结[J]. 中国水产, 2000(11): 42−44, 47. doi: 10.3969/j.issn.1002-6681.2000.11.038Xu Yiping. Summary of productive techniques of artificial breeding Sinonovacula constricta[J]. China Fisheries, 2000(11): 42−44, 47. doi: 10.3969/j.issn.1002-6681.2000.11.038 [16] 莫永凯. 贝类养殖技术之三连云港沿海缢蛏工厂化人工育苗技术[J]. 中国水产, 2008(6): 55. doi: 10.3969/j.issn.1002-6681.2008.06.036Mo Yongkai. Industrialized artificial breeding techniques for Sinonovacula constricta in coast of Lianyungang[J]. China Fisheries, 2008(6): 55. doi: 10.3969/j.issn.1002-6681.2008.06.036 [17] Liu Yanzi, Yao Hanhan, Zhou Tingting, et al. The discovery of circadian rhythm of feeding time on digestive enzymes activity and their gene expression in Sinonovacula constricta within a light/dark cycle[J]. Frontiers in Marine Science, 2021, 8: 744212. doi: 10.3389/fmars.2021.744212 [18] Liu Yanzi, He Qinyuan, Yao Hanhan, et al. Circadian clock genes Bmal1 and Period may regulate nocturnal spawning by controlling sex hormone secretion in razor clam Sinonovacula constricta[J]. Frontiers in Marine Science, 2022, 9: 1074816. doi: 10.3389/fmars.2022.1074816 [19] 闫红伟. 缢蛏(Sinonovacula constricta)和青蛤(Cyclina Sinensis)繁殖生理学的研究[D]. 青岛: 中国海洋大学, 2009.Yan Hongwei. Studies on reproductive physiology of Sinonovacula constricta and Cyclina sinensis[D]. Qingdao: Ocean University of China, 2009. [20] Raible F, Takekata H, Tessmar-Raible K. An overview of monthly rhythms and clocks[J]. Frontiers in Neurology, 2017, 8: 189. doi: 10.3389/fneur.2017.00189 [21] 冀佳悦, 张蕾, 程云霞, 等. 粘虫生物钟 timeless基因的克隆及时空和昼夜表达分析[J]. 植物保护学报, 2018, 45(4): 670−678.Ji Jiayue, Zhang Lei, Cheng Yunxia, et al. Molecular cloning and spatiotemporal and diurnal expression of the clock gene timeless in the oriental armyworm, Mythimna separata (Walker)[J]. Journal of Plant Protection, 2018, 45(4): 670−678. [22] Summa K, Urbanski J M, Zhao Xiumei, et al. Cloning and sequence analysis of the circadian clock genes period and timeless in Aedes albopictus (Diptera: Culicidae)[J]. Journal of Medical Entomology, 2012, 49(3): 777−782. doi: 10.1603/ME11171 [23] Brown S A, Ripperger J, Kadener S, et al. Period1-associated proteins modulate the negative limb of the mammalian circadian oscillator[J]. Science, 2005, 308(5722): 693−696. doi: 10.1126/science.1107373 [24] Sellix M T. Circadian clock function in the mammalian ovary[J]. Journal of Biological Rhythms, 2015, 30(1): 7−19. doi: 10.1177/0748730414554222 [25] 张正敏, 曹洪战, 芦春莲, 等. 生物钟对动物糖脂代谢的影响研究进展[J]. 中国畜牧杂志, 2020, 56(1): 30−34.Zhang Zhengmin, Cao Hongzhan, Lu Chunlian, et al. Research progress on effect of biological clock on animal glucose and lipid metabolism[J]. Chinese Journal of Animal Science, 2020, 56(1): 30−34. [26] Myers M P, Wager-Smith K, Rothenfluh-Hilfiker A, et al. Light-induced degradation of TIMELESS and entrainment of the Drosophila circadian clock[J]. Science, 1996, 271(5256): 1736−1740. doi: 10.1126/science.271.5256.1736 [27] Redlin U, Nuesslein B, Schmidt I. Circadian changes of brown adipose tissue thermogenesis in juvenile rats[J]. American Journal of Physiology, 1992, 262(3): R504−R508. [28] 李豪. 中华绒螯蟹Myosin Va、CHH和Timeless基因在其不同发育阶段的表达谱分析[D]. 南京: 南京师范大学, 2018.Li Hao. Expression profile analysis of Myosin Va, CHH and Timeless genes in different developmental stages of Eriocheir sinensis[D]. Nanjing: Nanjing Normal University, 2018. [29] Matsumoto T, Osada M, Osawa Y, et al. Gonadal estrogen profile and immunohistochemical localization of steroidogenic enzymes in the oyster and scallop during sexual maturation[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1997, 118(4): 811−817. doi: 10.1016/S0305-0491(97)00233-2 [30] Siah A, Pellerin J, Benosman A, et al. Seasonal gonad progesterone pattern in the soft-shell clam Mya arenaria[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2002, 132(2): 499−511. [31] Di Cosmo A, Di Cristo C, Paolucci M. Sex steroid hormone fluctuations and morphological changes of the reproductive system of the female of Octopus vulgaris throughout the annual cycle[J]. Journal of Experimental Zoology, 2001, 289(1): 33−47. doi: 10.1002/1097-010X(20010101/31)289:1<33::AID-JEZ4>3.0.CO;2-A [32] Gauthier-Clerc S, Pellerin J, Amiard J C. Estradiol-17β and testosterone concentrations in male and female Mya arenaria (Mollusca bivalvia) during the reproductive cycle[J]. General and Comparative Endocrinology, 2006, 145(2): 133−139. doi: 10.1016/j.ygcen.2005.08.004 [33] Osada M, Mori K, Nomura T. In vitro effects of estrogen and serotonin on release of eggs from the ovary of the scallop[J]. Nippon Suisan Gakkaishi, 1992, 58(2): 223−227. doi: 10.2331/suisan.58.223 [34] Wang Chunde, Croll R P. Effects of sex steroids on in vitro gamete release in the sea scallop, Placopecten magellanicus[J]. Invertebrate Reproduction & Development, 2003, 44(2/3): 89−100. -



 下载:
下载: