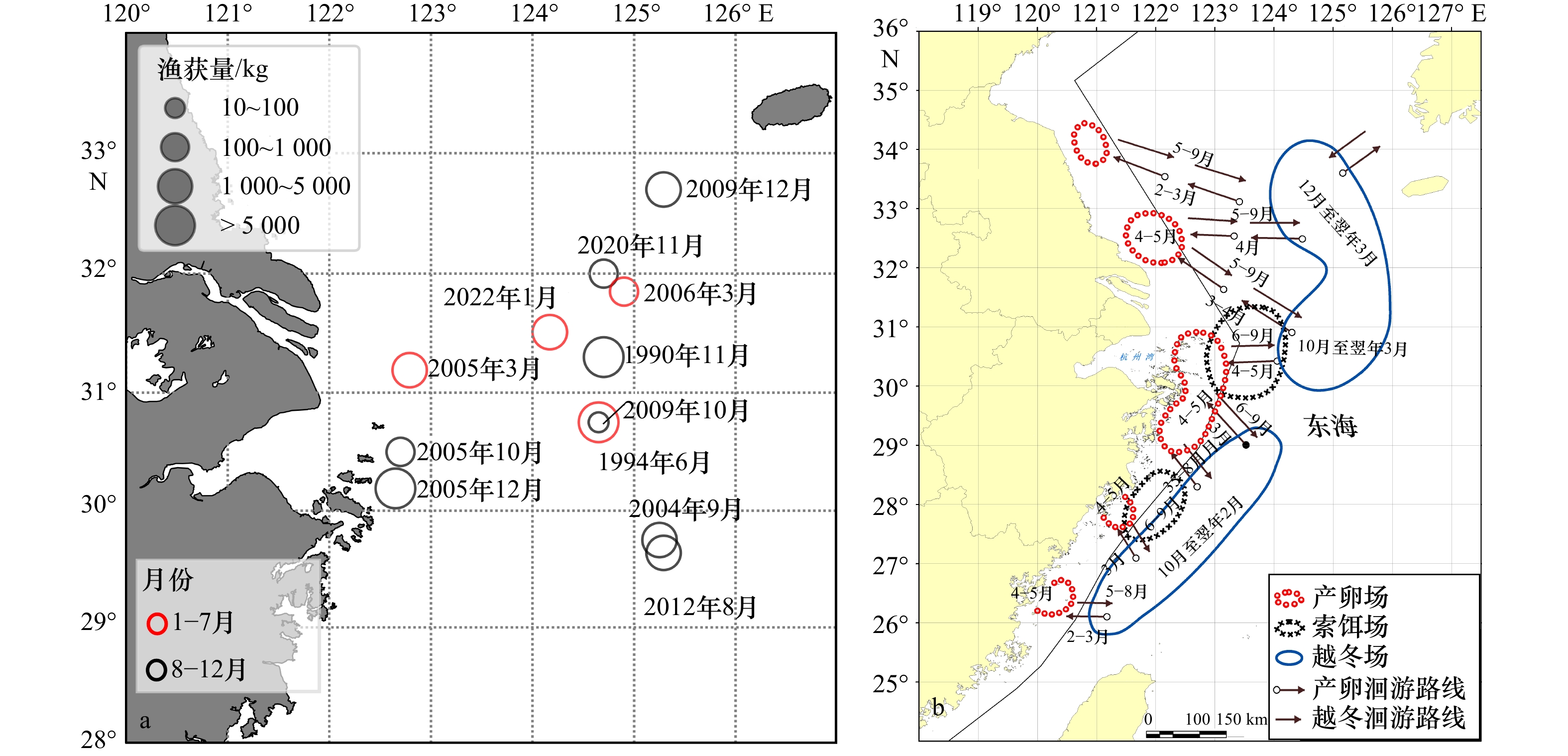
Speculation of migration routes of Larimichthys crocea in the East China Sea based on otolith microchemistry
-
摘要: 近年来,东海频现对大黄鱼(Larimichthys crocea)大网捕获(吨级规模以上),引起了对衰退中的野生大黄鱼资源保护的担忧。为查明东海野生大黄鱼洄游规律,本文根据2020−2022年在浙江近海产卵场和外海越冬场采集的不同批次野生大黄鱼样本,利用激光剥蚀电感耦合等离子体质谱法(LA-ICP-MS)测定耳石微化学元素,结合聚类分析和主成分分析(PCA),对不同大黄鱼群体进行了划分,结合耳石的年轮特征,研究大黄鱼群体的栖息生境,推测大黄鱼洄游路线。结果表明,Ba/Ca
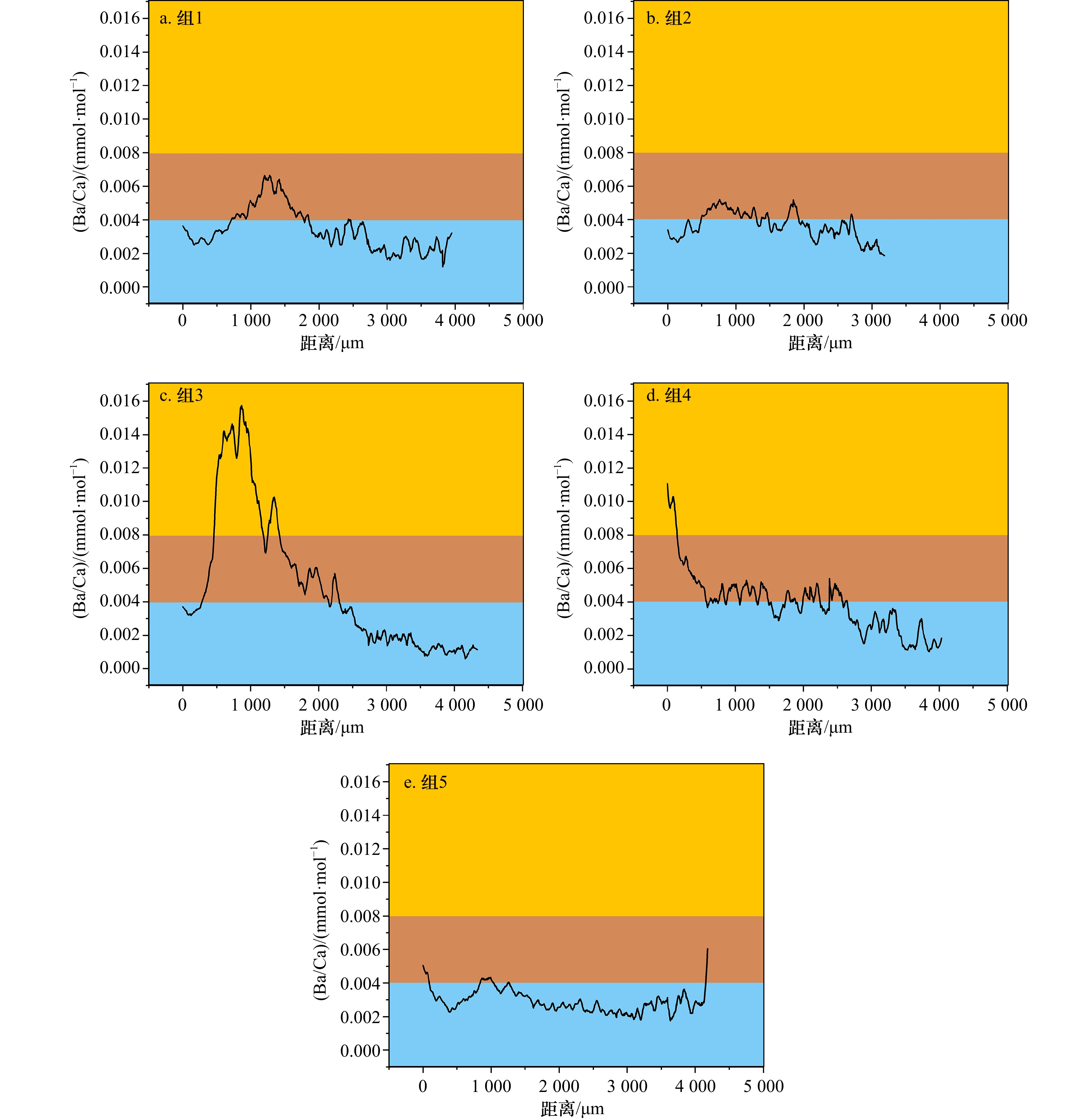
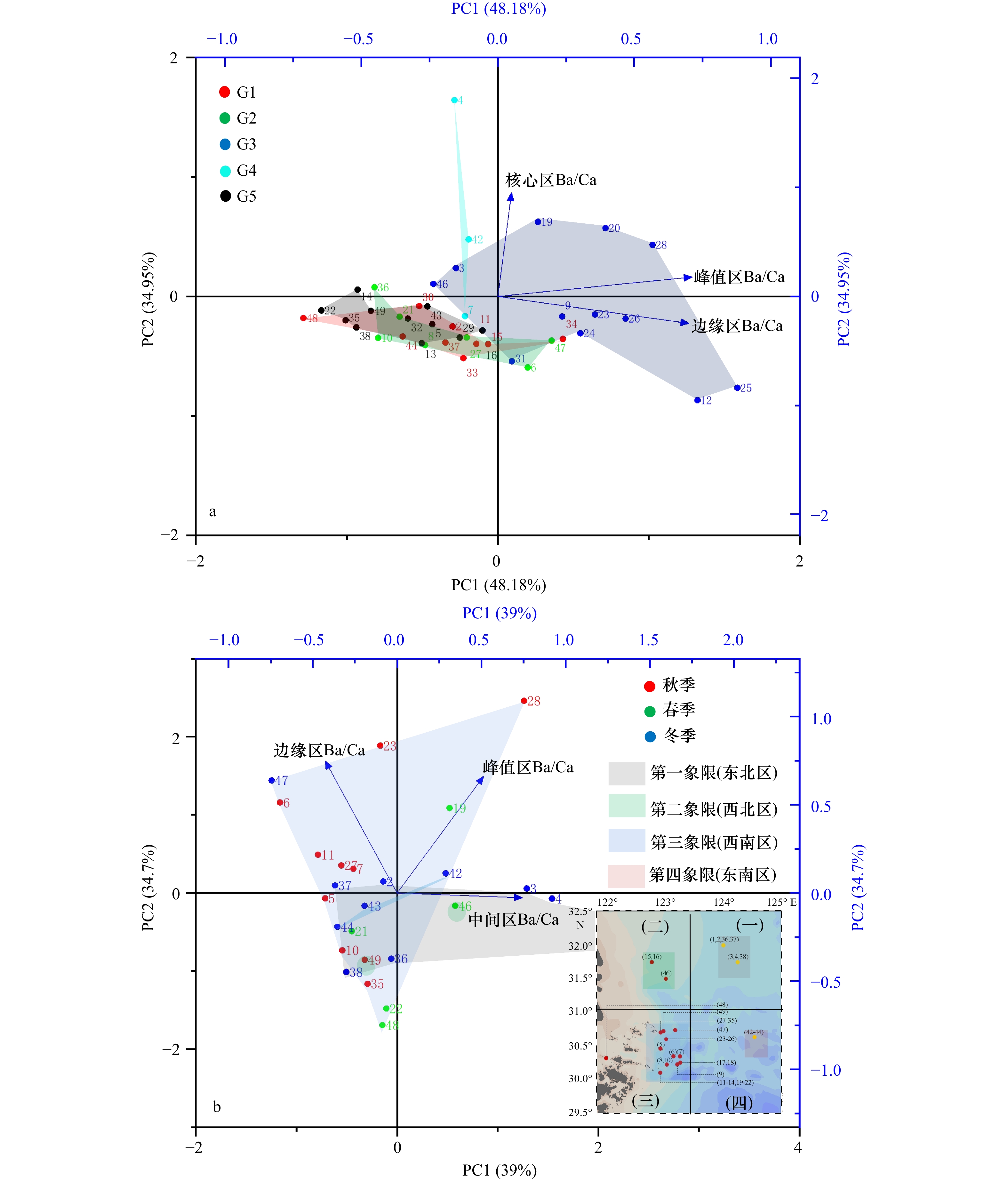
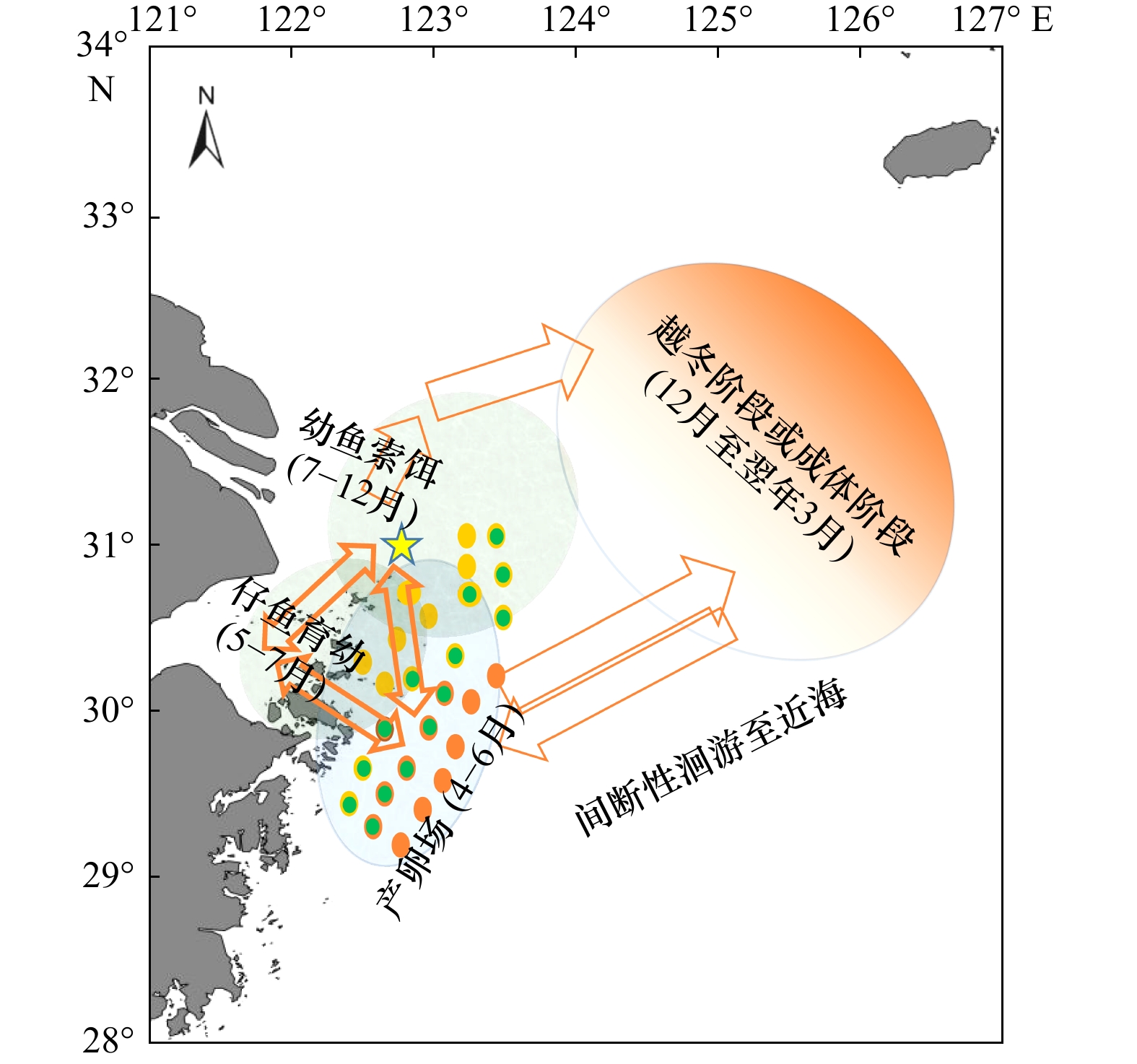
$\leqslant$ 0.004 2时可以判定为海洋栖息生境,Ba/Ca$\geqslant$ 0 .008 1时可以判定为河口栖息生境,0.004 2 < Ba/Ca< 0.008 1时可以判定为混合栖息生境。根据该阈值范围,判定本次采样的大黄鱼的5种生境类型:(1)近海产卵,近海混合水域短暂栖息类型(占22.2%);(2)近海产卵,阶段性往复混合生境栖息类型(占15.6%);(3)近海产卵,河口水域育幼索饵,外海越冬栖息类型(31.1%);(4)河口产卵、混合水域育幼,外海越冬栖息类型(6.7%);(5)近海混合水域短暂产卵,绝大部分时间海洋生境栖息类型(24.4%)。对所有样本的Ba/Ca核心、峰值和边缘值进行PCA,5种栖息类型的样本均匀分布在第一轴的两侧,大部分时间都在海洋生境中的G1、G2和G5,以及受陆源影响较大的G3和G4。同时,PCA结果同时也显示,5种类型样本均会近同步地在近海岛礁处出现,这表明外海、近海和河口的群体由于洄游等因素的影响会出现混合,说明了舟山岛礁水域对大黄鱼产卵育幼的重要性。本研究为东海大黄鱼近海产卵场、索饵场和外海越冬场之间洄游履历,以及大黄鱼洄游路线推测提供一定依据。Abstract: In recent years, large yellow croaker (LYC) has been caught with high abundance in the East China Sea (ECS), which raises concerns about the conservation of LYC resources. We collected LYC samples from spawning grounds and wintering grounds in the offshore Zhejiang from 2020 to 2022. In order to find out the migration route of LYC in the ECS, we made use of otolith microchemical elements by LA-ICP-MS analysis, combined with the clustering analysis and PCA of trace elements such as Ba/Ca, to classify different LYC groups. With the age characteristics of otolith, the habitat patterns of LYC group was studied, and the updated migration route of LYC was speculated. The results showed that groups with Ba/Ca$\leqslant$ 0.004 2 was inhabited in the marine region. That with Ba/Ca$\geqslant$ 0.008 1 was inhabited in the estuary region, and that with 0.004 2 < Ba/Ca < 0.008 1 was inhabited in the mixed (estuary and oceanic) habitat. The five group types of LYC were: (1) offshore spawning, short-term mixed waters inhabited (accounting for 22.2%); (2) offshore spawning, periodically back and forth with mixed water inhabited (accounting for 15.6%); (3) offshore spawning, feeding and nursering in estuary waters, and wintering inhabited in the open sea (31.1%); (4) estuary spawning, nursering in the mixed waters, overwintering inhabited in the open sea (6.7%); (5) shortly spawning in the mixed waters, most of the time inhabited in the open ocean (24.4%). PCA was performed with Ba/Ca core, peak and edge values of all samples, and the results showed that samples from five groups were evenly distributed on both sides of the first axis: G1, G2 and G5 groups, which spent most of their time in the ocean, and G3 and G4 groups, which were heavily influenced by terrestrial sources. At the same time, the PCA results also showed that all the samples appeared nearly synchronously near the island or reefs, indicating that populations in the open sea, offshore and estuary waters may mix due to factors such as migration, indicating the importance of Zhoushan offshore waters for LYC nursering and spawning. This study provides a certain basis for the migration history of the LYC in the ECS between its coastal spawning, feeding grounds and its overwintering grounds in the open sea, as well as for the speculation of its migration routes. -
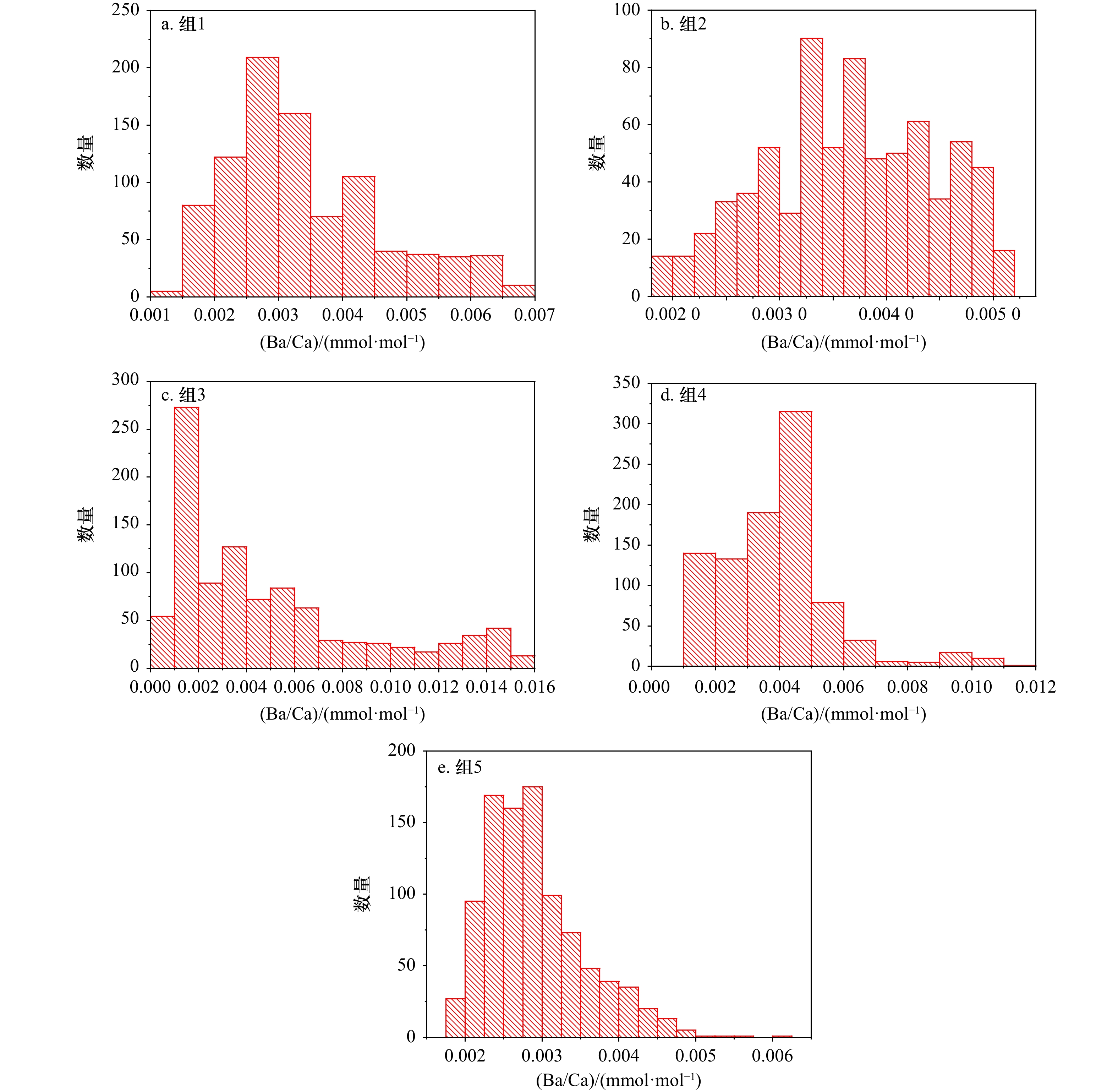
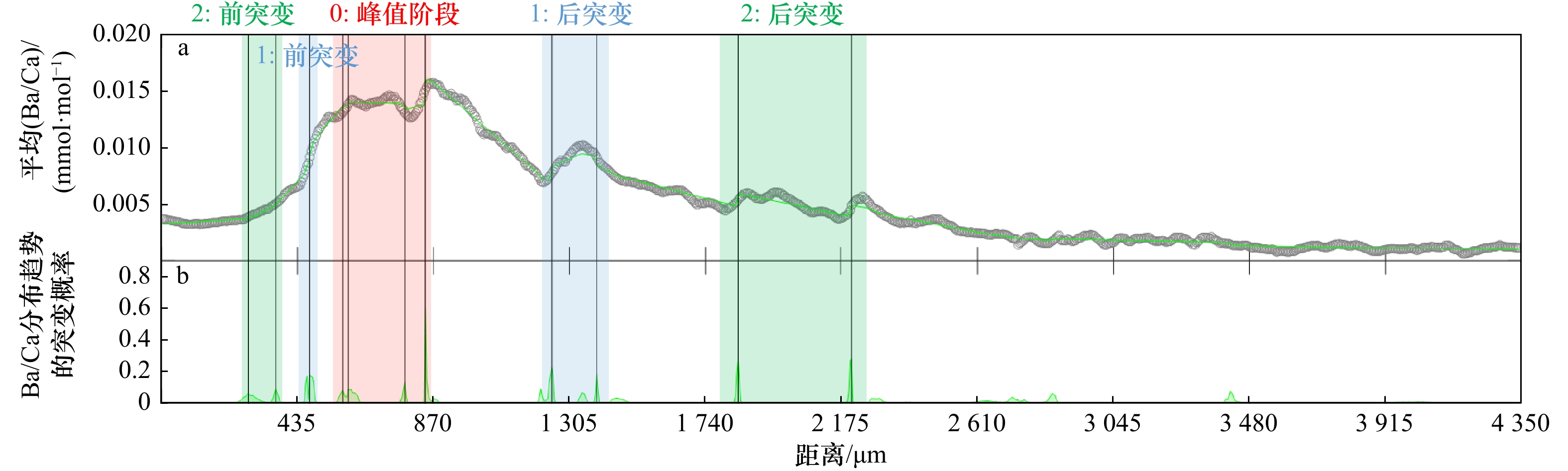
图 6 G3所有样本耳石平均Ba/Ca(a)及突变概率(b)
黑圈状折线为G3从耳石核心至边缘的Ba/Ca分布,绿色线为概率,红色、蓝色和绿色阴影区分别表示0峰值阶段,前后第一次突变,前后第二次突变对应的折线
Fig. 6 Average of Ba/Ca (a) and its trend change probability (b) in G3 otolith samples
Black circle line indicate Ba/Ca curve from otolith core to edge in G3, green line indicate probability, red, blue and green shade indicates peak, first trend change point lines, and second change point lines
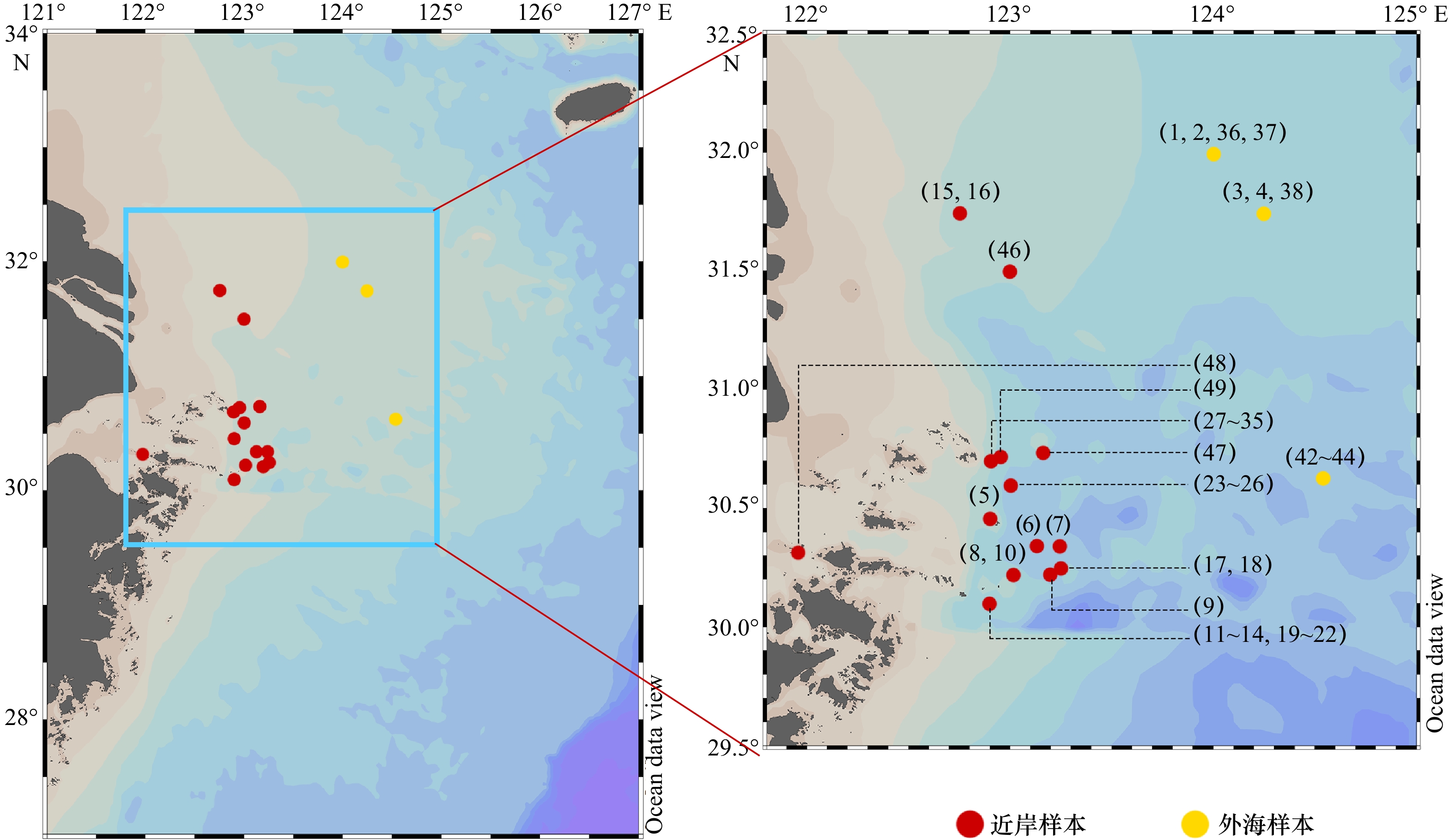
表 1 大黄鱼的样品采样信息
Tab. 1 Sampling details of Larimichthys crocea in the present study
年份 季节 样本数量 样本编号 体长范围
/cm体质量范围
/g2020 秋季 6* 1,2,23~26 29.7~33.4 334.7~437.4 2021 春季 1 46 30.5 427 2021 秋季 9 27~35 13.9~16.9 48.1~74.3 2022 春季 8* 19~22,42~44,48 13.3~27.0 30.5~109.1 2022 秋季 14 5~18 9.5~41.0 16.3~646.0 2022 冬季 7* 3~4,36~38,47,49 25.0~44.8 234.8~1144.3 注:*代表部分样本无体长、体质量数据。 表 2 东海大黄鱼耳石Mg、Mn、Sr、Ba 4种元素的变异程度
Tab. 2 Degree of variations of Mg, Mn, Sr, Ba in the otoliths of Larimichthys crocea in the East China Sea
指标 均值/(mmol·mol−1) 标准差/(mmol·mol−1) 最小值
/(mmol·mol−1)中位数
/(mmol·mol−1)最大值
/(mmol·mol−1)变异系数
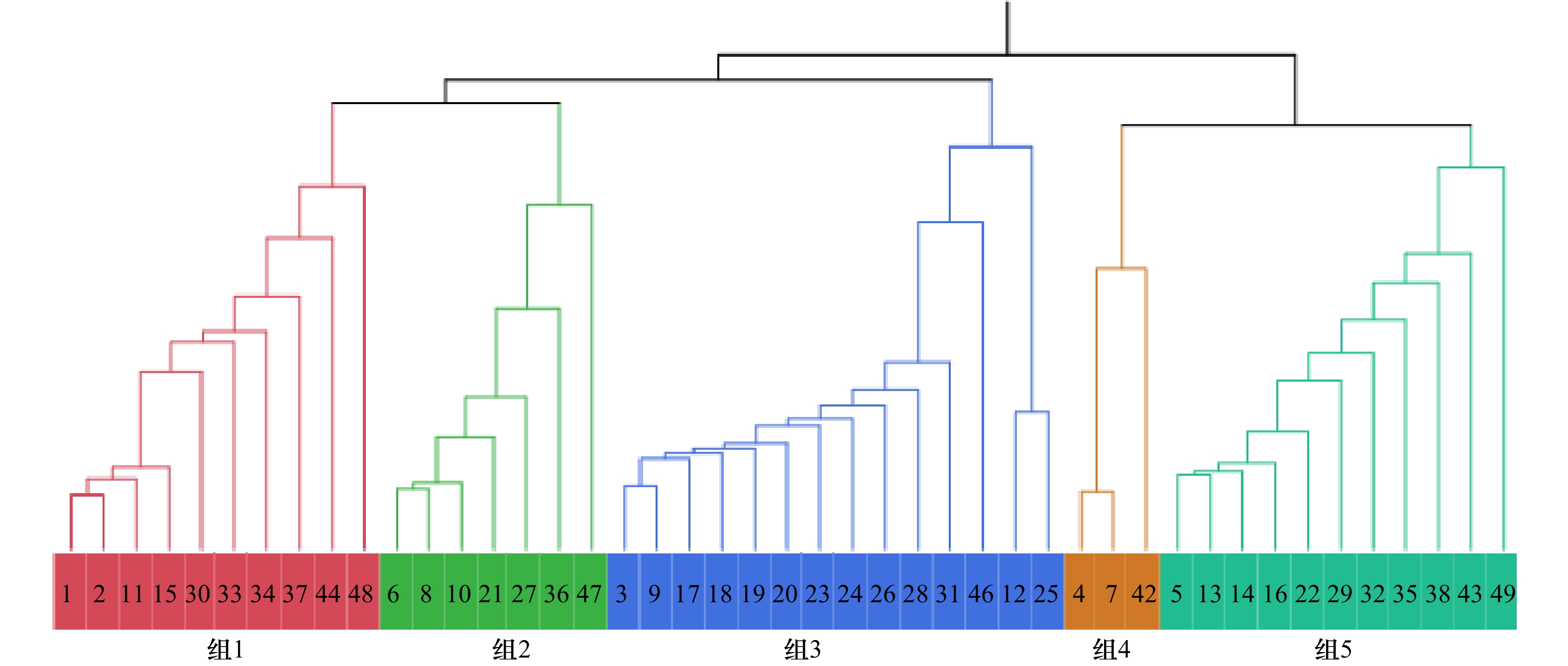
/%Sr/Ca 2.36 0.56 0.67 2.28 7.28 23.50 Ba/Ca 4.76 × 10−3 0.01 1.06 × 10−4 3.4 × 10−3 0.09 112.05 Mg/Ca 0.08 0.06 0.01 0.06 3.46 86.42 Mn/Ca 0.01 0.01 4.49 × 10−5 0.01 0.15 75.72 表 3 4个组群Ba/Ca的变异程度
Tab. 3 Variation degree of Ba/Ca in four groups
分组 均值/(mmol mol−1) 标准差/(mmol mol−1) 变异系数/% G1 3.85 × 10−3 1.88 × 10−3 48.12 G2 3.83 × 10−3 1.6 × 10−3 42.15 G3 7.4 × 10−3 6.38 × 10−3 84.88 G4 3.2 × 10−3 2.25 × 10−3 55.31 G5 3.36 × 10−3 1.21 × 10−3 38.33 -
[1] 李立华, 严小军, 王健鑫, 等. 浙江近海大黄鱼和带鱼产量的长期变化及资源评估: 基于历史统计数据分析[J]. 浙江海洋大学学报(自然科学版), 2022, 41(1): 63−69.Li Lihua, Yan Xiaojun, Wang Jianxin, et al. Long-term change of yield and stock assessment of Larimichthys crocea and Trichiurus lepturus in Zhejiang coastal waters based on historical data[J]. Journal of Zhejiang Ocean University (Natural Science), 2022, 41(1): 63−69. [2] 王俊禄, 许舜达, 黄筱. 刚有所恢复的东海野生大黄鱼, 别又被捕“黄”了[EB/OL]. [2023−06−18]. https://finance.sina.com.cn/jjxw/2022-01-28/doc-ikyakumy3063440.shtml?cref=cj.Wang Junlu, Xu Shunda, Huang Xiao. Do not let the shortly recovered wild yellow croakers in the East China Sea starting to get down[EB/OL]. [2023−06−18]. https://finance.sina.com.cn/jjxw/2022-01-28/doc-ikyakumy3063440.shtml?cref=cj. [3] 林上军, 王菲. 浙江舟山为保护区海钓管理立法[EB/OL]. [2023−06−18]. https://www.mnr.gov.cn/dt/hy/202303/t20230308_2777730.html.Lin Shangjun, Wang Fei. Zhejiang Zhoushan make laws for sea fishing management in protected areas[EB/OL]. [2023−06−18]. https://www.mnr.gov.cn/dt/hy/202303/t20230308_2777730.html. [4] 杨德康, 林飞. 浙江北部近海大黄鱼生殖群体现状[J]. 浙江水产学院学报, 1988, 6(1): 73−77.Yang Dekang, Lin Fei. On present conditions of the spawning population of Pseudosciaena crocea (Richardson) in the coastal waters of northern Zhejiang and suggestions about its fisheries management[J]. Journal of Zhejiang College of Fisheries, 1988, 6(1): 73−77. [5] 徐兆礼, 陈佳杰. 东黄海大黄鱼洄游路线的研究[J]. 水产学报, 2011, 35(3): 429−437.Xu Zhaoli, Chen Jiajie. Analysis of migratory route of Larimichthys crocea in the East China Sea and Yellow Sea[J]. Journal of Fisheries of China, 2011, 35(3): 429−437. [6] 俞存根, 严小军, 蒋巧丽, 等. 东海岱衢族大黄鱼资源变动的原因探析及重建策略[J]. 水产学报, 2022, 46(4): 616−625.Yu Cungen, Yan Xiaojun, Jiang Qiaoli, et al. Cause analysis of resources change and reconstruction strategy of Larimichthys crocea Daiqu group in the East China Sea[J]. Journal of Fisheries of China, 2022, 46(4): 616−625. [7] 周永东, 李圣法. 东海区主要经济种类三场一通道及保护区图集[M]. 北京: 海洋出版社, 2018: 1-116.Zhou Yongdong, Li Shengfa. Atlas of Three Fisheries Ground, One Migration Route and Protected Areas in the East China Sea[M]. Beijing: China Ocean Press, 2018: 1−116. [8] Secor D H, Rooker J R. Is otolith strontium a useful scalar of life cycles in estuarine fishes?[J]. Fisheries Research, 2000, 46(1/3): 359−371. [9] Walther B D, Thorrold S R. Water, not food, contributes the majority of strontium and barium deposited in the otoliths of a marine fish[J]. Marine Ecology Progress Series, 2006, 311: 125−130. doi: 10.3354/meps311125 [10] 熊瑛, 刘洪波, 汤建华, 等. 耳石微化学在海洋鱼类洄游类型和种群识别研究中的应用[J]. 生命科学, 2015, 27(7): 953−959. doi: 10.13376/j.cbls/2015132Xiong Ying, Liu Hongbo, Tang Jianhua, et al. Application of otolith microchemistry on reconstruction of migratory patterns and stock discrimination in marine fishes[J]. Chinese Bulletin of Life Sciences, 2015, 27(7): 953−959. doi: 10.13376/j.cbls/2015132 [11] 罗军燕, 李胜荣, 申俊峰. 鱼耳石中锶和钡富集的影响因素及其环境响应[J]. 地学前缘, 2008, 15(6): 18−24.Luo Junyan, Li Shengrong, Shen Junfeng. The influential factors of strontium and barium enrichment in otolith and their response to the environment[J]. Earth Science Frontiers, 2008, 15(6): 18−24. [12] 黎雨轩, 徐浩, 张翼, 等. 环境因子对大黄鱼耳石钡元素富积的影响[J]. 海洋渔业, 2014, 36(5): 409−417.Li Yuxuan, Xu Hao, Zhang Yi, et al. Effects of environmental factors on otolith Ba element incorporation in juvenile Larimichthys crocea[J]. Marine Fisheries, 2014, 36(5): 409−417. [13] 刘志远. 基于耳石形态及微结构特征的大黄鱼和小黄鱼早期生长发育研究[D]. 上海: 上海海洋大学, 2012.Liu Zhiyuan. Early growth and development of big yellow croaker (Larimichthys crocea) and small yellow croaker (Larimichthys polyactis) based on morphological development and microstructure of otolith[D]. Shanghai: Shanghai Ocean University, 2012. [14] 林静远, 刘必林, 陈新军. 头足类角质颚微化学及其在渔业生态学中的应用研究进展[J]. 大连海洋大学学报, 2019, 34(2): 280−287.Lin Jingyuan, Liu Bilin, Chen Xinjun. Advances on cephalopod beak microchemistry and its application in fishery ecology: a review[J]. Journal of Dalian Ocean University, 2019, 34(2): 280−287. [15] 熊瑛, 刘洪波, 刘培廷, 等. 基于耳石元素微化学的江苏吕泗近岸小黄鱼生境履历重建[J]. 应用生态学报, 2014, 25(3): 836−842.Xiong Ying, Liu Hongbo, Liu Peiting, et al. Reconstructing habitat history of Larimichthys polyactis in Lüsi coastal waters of Jiangsu Province, China based on otolith microchemistry[J]. Chinese Journal of Applied Ecology, 2014, 25(3): 836−842. [16] Zhao Kaiguang, Wulder M A, Hu Tongxi, et al. Detecting change-point, trend, and seasonality in satellite time series data to track abrupt changes and nonlinear dynamics: a Bayesian ensemble algorithm[J]. Remote Sensing of Environment, 2019, 232: 111181. doi: 10.1016/j.rse.2019.04.034 [17] Menezes R, Moura P E S, Santos A C A, et al. Habitat use plasticity by the dog snapper (Lutjanus jocu) across the Abrolhos Bank shelf, eastern Brazil, inferred from otolith chemistry[J]. Estuarine, Coastal and Shelf Science, 2021, 263: 107637. doi: 10.1016/j.ecss.2021.107637 [18] Zhang Shuai, Jiang Yan’e, Li Min, et al. Life history of spinyhead croaker Collichthys lucidus (Sciaenidae) differentiated among populations from Chinese coastal waters[J]. Aquatic Biology, 2022, 31: 65−76. doi: 10.3354/ab00754 [19] Tabouret H, Bareille G, Claverie F, et al. Simultaneous use of strontium: calcium and barium: calcium ratios in otoliths as markers of habitat: application to the European eel (Anguilla anguilla) in the Adour basin, south West France[J]. Marine Environmental Research, 2010, 70(1): 35−45. doi: 10.1016/j.marenvres.2010.02.006 -







 下载:
下载: