Study on the impacts of crown-of-thorns starfish on nutrient dynamics in the coral reef sediments
-
摘要: 长棘海星暴发对珊瑚礁生态系统产生了严重危害,而水体营养盐的补充可能是导致长棘海星暴发的一个关键因素。砂质沉积物对调控珊瑚礁区的营养盐浓度和结构起着关键作用,因此本研究通过流动式反应器对长棘海星和砂质沉积物进行模拟实验,分析长棘海星排泄活动及其死亡后有机体降解对水体营养盐的影响,并探究砂质沉积物的响应。实验结果表明:(1)长棘海星排泄的溶解无机氮(DIN)和溶解无机磷(DIP)通量分别为(83.55±4.74)μmol/(ind.·h)和(2.53±0.03)μmol/(ind.·h),这些营养盐可能给长棘海星的持续暴发提供营养条件;(2)砂质沉积物对长棘海星排泄导致的营养盐浓度升高具有缓冲作用,约70.7%的DIN和91.4%的DIP被截留在沉积物中,但沉积物界面营养盐交换导致的氮磷比升高可能不利于珊瑚生长;(3)长棘海星死后的有机体降解可促使沉积物–水界面释放营养盐,结合海星暴发密度估算,其释放的营养盐可导致上覆水中DIN和DIP浓度分别升高0.32 μmol/L和0.01 μmol/L,这可能会促使大型藻的快速生长而妨碍珊瑚的自我修复。Abstract: The outbreak of crown-of-thorns starfish has seriously threatened the ecological health of coral reefs, and the supplement of nutrients in seawater may be a key factor leading to the outbreak of starfish. Sandy sediments play a key role in regulating the nutrient concentration and structure in coral reefs. Therefore, crown-of-thorns starfish and sandy sediments were incubated using flow-through reactor, to analyze the effects of crown-of-thorns starfish excretion and dead body degradation on nutrient concentration and structure, and to explore the role of sandy sediments under activities of crown-of-thorns starfish. The results were as followed: (1) crown-of-thorns starfish excreted dissolved inorganic nitrogen (DIN) and dissolved inorganic phosphorus (DIP) at rates of (83.55±4.74) μmol/(ind.·h) and (2.53±0.03) μmol/(ind.·h), respectively, which maight provide nutritional conditions for the continuous outbreak of starfish; (2) sandy sediments could regulate the nutrient concentration changed by the excretion of starfish, about 70.7% of DIN and 91.4% of DIP were trapped in the sediments, but the increase of DIN/DIP caused by nutrient exchange at the sediment-seawater interface may be detrimental to coral growth; (3) the degradation of starfish organisms could promote the release of nutrients at the sediment-seawater interface. Based on the density of starfish, the released nutrients could cause the concentrations of DIN and DIP in the overlying water to increase by 0.32 μmol/L and 0.01 μmol/L, respectively, which maight promote the rapid growth of macroalgae and hinder the self-restoration of corals.
-
Key words:
- crown-of-thorns starfish /
- sediments /
- coral reefs /
- nutrients /
- ecological impacts
-
1. 引言
长棘海星或称为棘冠海星(Acanthaster planci),属于棘皮动物门,海星纲,有棘目,长棘海星科,长棘海星属。长棘海星是珊瑚捕食者,主要以造礁石珊瑚为食,其大量暴发会对珊瑚礁造成巨大损害[1-3]。在澳大利亚大堡礁中北部海域,长棘海星暴发对珊瑚的影响远远大于包括珊瑚白化在内的其他干扰因素[4]。根据De’ath等[4]对世界上200多个珊瑚礁的统计显示,1985–2012年期间活珊瑚覆盖率从28.0%下降至13.8%,而这其中由长棘海星造成的损害达到了惊人的42%,远远大于珊瑚白化造成的10%。由此可见,长棘海星对珊瑚有着极强的破坏性。长棘海星暴发除了直接影响珊瑚外,还会造成珊瑚礁区生态系统的不平衡、不稳定[5],例如,底栖大型海藻迅速占据珊瑚生长空间[6],造成珊瑚礁区的鱼类多样性减少等诸多负面影响[7]。
长棘海星暴发与海水营养盐浓度有着千丝万缕的联系,有学者认为海水营养盐的补充是造成海星大面积暴发的重要原因[2, 8],水体营养盐补充可以提高长棘海星幼体的存活率,有利于长棘海星成体数量增加[8]。在营养丰富的海水中,通常有较高的浮游植物量,以浮游生物为食的长棘海星幼体存活率很高,反之,则很少有海星幼体完成发育[9]。水体富营养化,浮游植物增长暴发,浮游生物群落结构加剧改变,都可能进一步促进长棘海星的暴发[8-10]。此外,长棘海星的幼体容易遭到珊瑚礁鱼类的捕食,如耳带蝴蝶鱼(Chaetodon auripes)和纹带蝴蝶鱼(Chaetodon falcula)等,可以抑制海星幼体的存活率[11-12],但珊瑚鱼类捕食健康成年海星则相对罕见[13]。
沉积物–海水界面的物质交换对维持海洋初级生产力和浅海营养盐平衡有着显著作用[14-15],但长棘海星等底栖生物活动可能会干扰或打破这种平衡[16]。沉积物内的有机物在降解过程中会释放大量的营养盐,促进浮游植物的生长,在一定程度上支持了表层水体的初级生产力[17-18]。例如,大堡礁北部和中部海域的生产力在很大程度上是由沉积物中的有机氮、磷快速循环而维持的[19]。除此之外,渗透性沉积物对营养盐的吸收导致海水中氮磷比的降低,有利于近海珊瑚礁生态系统的稳定[20]。
尽管沉积物对营养盐生物地球化学循环起着关键作用,但在长棘海星排泄活动及其死后有机体降解过程中,沉积物界面营养盐动力学的响应机制尚不明确[20-22]。因此,本研究对长棘海星和沉积物进行受控培养,探讨长棘海星排泄活动和沉积物界面营养盐动力学对海水营养盐浓度和结构的影响,并分析海星有机体降解时沉积物界面营养盐交换通量的变化。该研究将丰富我们对长棘海星暴发期间珊瑚礁区营养盐循环的认识,为治理和防范长棘海星暴发提供科学理论基础。
2. 材料与方法
2.1 样品采集与实验培养
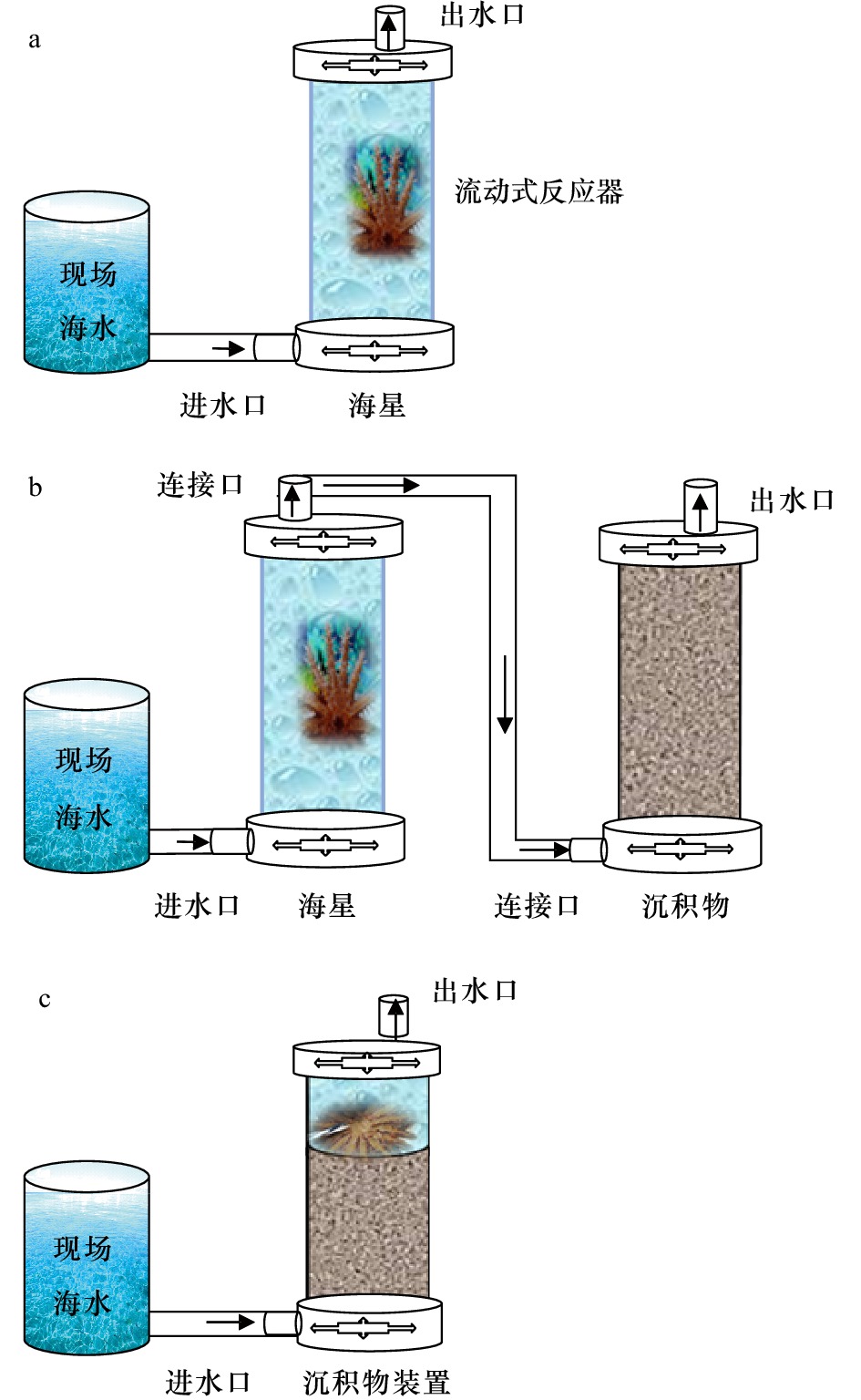
2020年6月,于南海宣德环礁礁区距海底5~15 m的礁盘采集长棘海星活体,将其保存到盛有海水的保温箱中,并用塑料样品袋和取水器分别采集表层沉积物和底层海水,在2 h内运送到调查船上的室内实验室,用于后续的培养实验。之所以采集此深度的样品是因为此深度的海星暴发密度最大,珊瑚遭受的破坏最为严重[22]。
根据研究目的,设计了3组实验,每组实验设2个平行样。实验装置由有机玻璃柱和带有出水口的上下两个盖子组合构成流动式反应器(FTR),装置底面积约为80 cm2,高为20 cm。培养过程采用水浴控温,温度为(29±0.5)℃,并用蠕动泵控制流进海水的流速。
第1组长棘海星培养实验,将采集的海星(海星体长约20 cm、重量630 g、腕足数量15 ind.)分别培养在单独的FTR中(图1a),以10 mL/min的流速向装置内泵入海水,使其达到稳定的状态,从进水口和出水口各收集两份50 mL的水样,过滤后在–20°C下冷冻保存,待测营养盐浓度。
第2组长棘海星与沉积物串联培养实验,将采集的沉积物中较大的珊瑚碎片和大型底栖生物去除并混匀沉积物,后将混匀的沉积物填充到FTR中,随后在第一组实验的基础上接入填充沉积物的装置(图1b)。泵入现场采集的海水,从进水口和出水口各收集两份50 mL的水样,过滤后在–20°C下冷冻保存,待测营养盐浓度。
第3组长棘海星有机体降解实验,将刚死亡的海星肢解并把其一腕足放到沉积物表面(此时长棘海星密度相当于85 000 ind./hm2),泵入现场采集的海水(图1c)。在培养的第1天、第2天、第4天和第14天,从进水口和出水口各采集两份50 mL的水样,过滤后在–20°C下冷冻保存,待测营养盐浓度。通过设置不同时间的取样序列,分析海星有机体降解对沉积物–海水界面营养盐交换通量的影响。
2.2 样品分析及计算方法
本实验的水样营养盐浓度均使用QuAAtro营养盐自动分析仪测定,溶解无机氮(Dissolved Inorganic Nitrogen, DIN)浓度为硝酸盐(
$\rm NO_3^- $ )、亚硝酸盐($\rm NO_2^- $ )和铵盐($\rm NH_4^+ $ )的浓度总和,溶解有机氮(Dissolved Organic Nitrogen, DON)浓度为总溶解氮(Total Dissolved Nitrogen, TDN)浓度减去溶解无机氮浓度。溶解无机磷(Dissolved Inorganic Phosphorus, DIP)采用磷钼蓝法测定,$\rm NO_2^- $ 采用重氮–偶氮法测定,$\rm NO_3^- $ 通过镉–铜还原为$\rm NO_2^- $ 测定,$\rm NH_4^+ $ 采用靛酚蓝法测定,硅酸盐(DSi)采用硅钼蓝法测定,TDN则使用过硫酸钾氧化法将所有溶解氮转化为$\rm NO_3^- $ 进行测定。分析的测量精度小于6%[23]。海星排泄营养盐通量F1(μmol/(ind.·h))的计算:流出装置的海水营养盐浓度(Cout)减去流进装置的海水营养盐浓度(Cin)再乘以流经每个海星的流速通量(T1),即0.6 L/(ind.·h),公式为
$$ F_1=(C_{\rm{out}}-C_{\rm{in}})\times T_1. $$ (1) 沉积物–水界面营养盐的交换通量F2(mmol/(m2·h))的计算:海水流速设置为10 mL/min,通过FTR后流速通量(T2)转换为126 L/(m2·h),C为流出液和流进液的营养盐浓度差,公式为
$$ F_2={\textit C}\times T_2, $$ (2) 式中,F2为正值代表沉积物中的营养盐被释放到海水中,负值代表沉积物吸收水体中的营养盐。
3. 结果与讨论
3.1 长棘海星的排泄活动对海水营养盐浓度和结构的影响
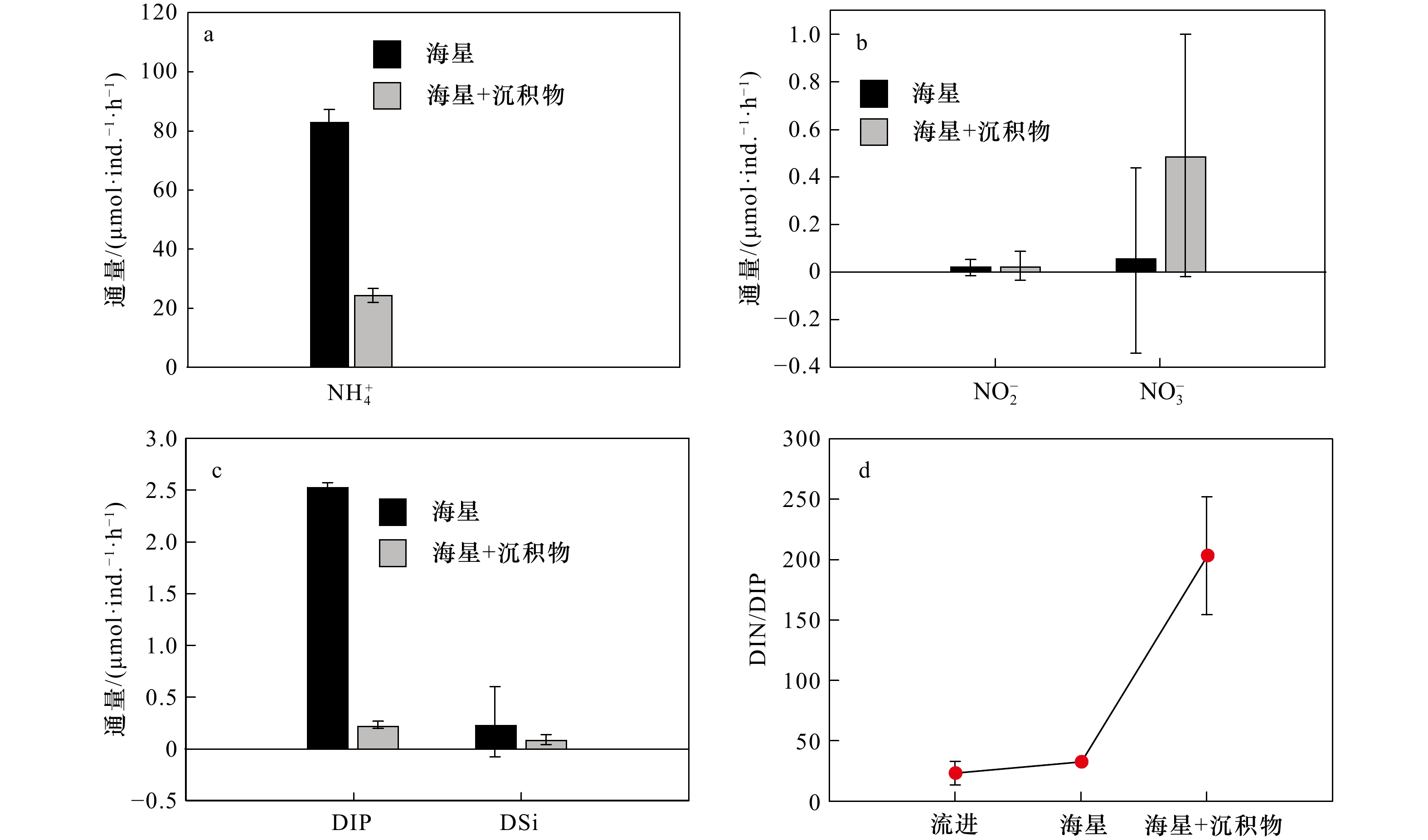
在第1组实验中,海星排泄释放出大量的DIN、DIP和DSi,它们的通量分别为(83.55±4.74)μmol/(ind.·h)、(2.53±0.03)μmol/(ind.·h)和(0.22±0.37)μmol/(ind.·h),释放的DIN主要以
$\rm NH_4^+ $ 的形态为主(图2)。根据现场调查的海星密度(1 000 ind./hm2)、水深(10 m)进行估算,每公顷长棘海星在1个月内排泄的营养盐可使海域内DIN和DIP的浓度分别升高0.60 μmol/L和0.02 μmol/L,其中,DIN浓度与西沙海域夏季(6月)表层海水DIN浓度(0.99 μmol/L)相近,与秋季(11月)DIN浓度(2.63 μmol/L)相差较大,而DIP浓度与夏秋季DIP浓度(0.10 μmol/L)差异相当[24-25],所以夏季DIN受海星排泄活动影响可能会高于秋季,而DIP浓度受海星排泄活动影响的季节性差异不大。因此,在长棘海星暴发期间,海星排泄释放的$\rm NH_4^+ $ 、DIP可能容易在营养盐浓度较低的季节给珊瑚礁海域补充大量氮、磷,并对浮游生物丰度产生潜在的生态影响。海星的排泄活动不仅影响了DIN和DIP的浓度,还改变了海水营养盐的结构。海星排泄后的水体氮磷比(DIN/DIP)高达33(图2d)。西沙海域DIN/DIP约为10,低于Redfield 比值。在一定情况下,DIN/DIP过高容易导致浮游植物大量繁殖。例如,Heil等[26]的实验表明,水体DIN/DIP为32的实验组适合硅藻类浮游植物生长。陈璐[25]在西沙海域的营养加富实验同样发现水体DIN/DIP为32的实验组叶绿素a(Chl a)的浓度有明显增加。由此,我们不难推测长棘海星排泄过后的水体DIN/DIP会对浮游植物量有较大影响。浮游植物作为长棘海星幼虫的食物来源[27],其大量生长将会给海星幼虫提供理想的生存条件。如Fabricius等[9]发现海星幼虫在Chl a浓度为2~6.5 μg/L时,具有发育速度快、成活率高等特点,且在约翰斯顿环礁[28]和南马里亚纳群岛[29]海域发生浮游植物暴发之后的两个月便发现了长棘海星的暴发。由此推测,在海星大面积暴发下,海星排泄可使水体营养盐浓度和DIN/DIP升高,浮游生物量有增长的趋势,从而给长棘海星幼虫提供有利的摄食环境,有助于长棘海星成体数量增加,使海星暴发的持续时间更为持久。
3.2 沉积物对长棘海星排泄活动的响应
通过第1组和第2组实验结果对比发现,海星排泄
$\rm NH_4^+ $ 总量中约有70.7%$\rm NH_4^+ $ 被截留在沉积物,但排泄的$\rm NO_2^- $ 和$\rm NO_3^- $ 流经沉积物后却有所增加,其中$\rm NO_3^- $ 增加了8.6倍(图2a,图2b)。这可能与沉积物中活跃的微生物活动有关[30]。例如将$\rm NH_4^+ $ 氧化为$\rm NO_2^- $ 和$\rm NO_3^- $ 的硝化细菌[31-32],沉积物中的低光照或无光照环境中更有利于这些细菌执行氨氧化过程[33]。沉积物中氧化铁等矿物对DIP有较强的吸附作用[34],在实验中海星排泄释放的DIP经过沉积物后同样被吸收了大部分,约有91.4%的DIP被截留在沉积物中(图2c)。这表明沉积物在海星暴发时可以起到一定的调节作用,从而降低海星排泄活动释放营养盐所造成的生态影响。南海宣德环礁底质类型包括砾、砂、珊瑚碎块及生物碎屑等,其中砂质沉积物几乎遍及整个海域[35-36]。尽管如此,本文仅基于砂质沉积物营养盐交换通量的数据来估算沉积物对海星排泄营养盐的截留效率存在一定的不确定性,所以需要开展不同底质类型的实验以获取更准确的数据。
尽管沉积物对海星排泄的营养盐吸收效果显著,但仍然有部分营养盐停留在海水中,且由于沉积物对DIP、DIN有不一样的截留效率,导致海水流经沉积物后的DIN/DIP远远高于Redfield比值,也高于海星排泄释放营养盐的水体(图2d)。高DIN/DIP的水体环境不仅会导致浮游植物大量繁殖[2],还会使水体向珊瑚供应的氮和磷失衡,珊瑚共生虫黄藻可能会因缺磷导致光合作用器官受损而发生白化[37]。因此,沉积物–海水界面的营养盐交换导致的DIN/DIP升高可能不利于珊瑚生长。
3.3 长棘海星有机体的降解对沉积物界面营养盐交换的影响
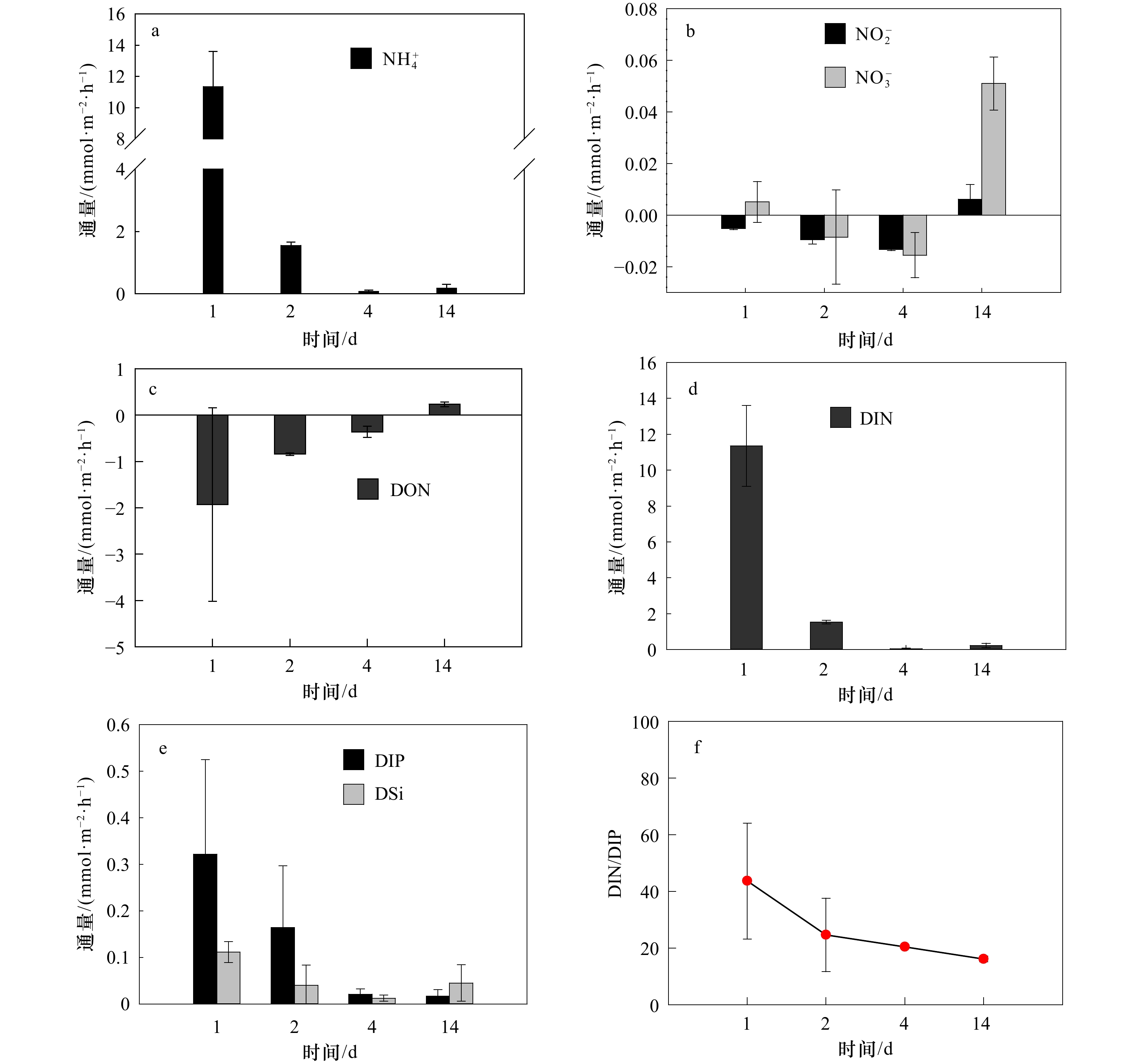
长棘海星不会无节制的繁殖、发育和暴发,海星暴发的持续时间会受到食物短缺、被捕食、疾病、繁殖活动和栖息地等环境因素的限制[2,8]。因此,在第3组实验中,我们探究海星死亡后有机体降解对沉积物营养盐动力学的影响。在实验初期,海星腕足开始腐败降解,通过FTR实验发现,沉积物释放DIN、DIP和DSi的交换通量分别为(11.35±2.3)mmol/(m2·h)、(0.32±0.2)mmol/(m2·h)、(0.11±0.02)mmol/(m2·h)。沉积物释放到水体的DIN以
$\rm NH_4^+ $ 形态为主,$\rm NO_2^- $ 和$\rm NO_3^- $ 多表现为被沉积物吸收,水体DIN/DIP也在此时检测到最高值(图3)。与DIN不同的是,沉积物会吸收水体中的DON,且在沉积物释放DIN通量最大时,沉积物对DON吸收通量也为最大(图3c,图3d),这表明沉积物可能需要吸收水体中的DON来补充其内部被快速消耗的有机物。渗透性砂质沉积物中孔隙水的对流会促进有机质的降解[38]。海星有机体在海水对流下快速降解,并在沉积物内的微生物作用下将有机物转化为无机物释放到海水中[30-31],从而影响水体DIN、DIP和DSi浓度。根据室内培养的海星密度(85 000 ind./hm2)换算成自然海区的海星密度(1 000 ind./hm2),海星死亡后的第1天,沉积物–水界面释放的营养盐可使其上覆水柱(以10 m计)中DIN和DIP浓度分别上升0.32 μmol/L和0.01 μmol/L。这些营养盐的补充可以缓解底栖藻类和蓝藻的营养限制[39],为其提供生长和繁殖所需的物质资源。Chen等[40]研究表明,大气氮输入易导致远离陆地的珊瑚礁区大型藻类数量增加,最终可能导致大型藻类丰富的礁区逐步取代以珊瑚为主的礁区[24]。因此,从营养盐角度考虑,注射化学毒剂或捕捞灭活等手段杀死长棘海星后仍将其保留在海中的方式并不是解决长棘海星暴发的根本方法,这不能缓解海星有机体降解释放营养盐所带来的生态影响。
海星有机体随着时间的慢慢推移将会被微生物完全降解。在实验后期,尤其是在实验第14天,海星有机体只剩下骨骼。此时的DIN、DIP和DSi的交换通量分别为(0.23±0.12)mmol/(m2·h)、(0.02±0.01)mmol/(m2·h)和(0.04±0.03)mmol/(m2·h),与实验初期相比降低了60%以上(图3)。但
$\rm NO_2^- $ 和$\rm NO_3^- $ 的交换通量恰恰相反,由吸收变为释放(图3b),DON也随着DIN的释放减少由吸收变为释放(图3c,图3d),DIN/DIP也由高值逐渐降低并趋向于Redfield比值(图3f)。由此可见,海星死亡后有机体降解促使沉积物释放的营养盐主要集中在短期内释放,但其释放总量不容小觑。南海表层海水本是贫营养的水体[41],长棘海星死后仍可为南海贫营养水体提供较为丰富的营养物质。新补充的DIN和DIP往往容易被底栖大型藻类吸收利用[42],而珊瑚被海星破坏后需要长时间的修复[22],在这期间,底栖大型藻类可能会趁机占据珊瑚生长空间,不利于恢复期珊瑚的自我修复。4. 结论
(1)在长棘海星暴发期,海水营养盐浓度和DIN/DIP易受海星排泄活动影响而升高,促使浮游生物量增加,从而为海星幼虫创造了适宜的生存条件,因此可能会延长海星暴发的持续时间。
(2)砂质沉积物对海星排泄导致的水体营养盐浓度升高可起到缓冲作用,将约70.7%的DIN和91.4%的DIP截留在沉积物中。虽然该作用效果显著,但仍然有部分营养盐停留在海水中,且沉积物–海水界面营养盐交换导致的DIN/DIP升高不利于珊瑚生长。
(3)长棘海星死亡后,海星有机体降解可促使沉积物在短期内释放大量营养盐,这些营养盐可能会被底栖大型藻类利用,导致藻类与珊瑚之间的竞争加剧,不利于海星暴发后期珊瑚的自我修复。
致谢:感谢三沙航迹珊瑚礁保护研究所为本研究提供的帮助。
-
-
[1] Muhando C A, Lanshammar F. Ecological effects of the crown-of-thorns starfish removal programme on Chumbe Island Coral Park, Zanzibar, Tanzania[C]//Proceedings of the 11th International Coral Reef Symposium. Fort Lauderdale: [s.n.], 2008: 1127–1131. [2] Caballes C F, Pratchett M S, Morgan S. Reproductive biology and early life history of the crown-of-thorns starfish[M]//Whitmore E. Echinoderms: Ecology, Habitats and Reproductive Biology. New York, USA: Nova Science Publishers, 2014: 101–146. [3] Pratchett M S, Caballes C F, Rivera-Posada J, et al. Limits to understanding and managing outbreaks of crown-of-thorns starfishes (Acanthaster spp.)[M]//Hughes R, Hughes D, Smith I. Oceanography and Marine Biology: An Annual Review. Boca Raton, FL: CRC Press, 2014: 133–200. [4] De’ath G, Fabricius K E, Sweatman H, et al. The 27-year decline of coral cover on the Great Barrier Reef and its causes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(44): 17995−17999. doi: 10.1073/pnas.1208909109 [5] Wilson S K, Graham N A J, Pratchett M S, et al. Multiple disturbances and the global degradation of coral reefs: are reef fishes at risk or resilient?[J]. Global Change Biology, 2006, 12(11): 2220−2234. doi: 10.1111/j.1365-2486.2006.01252.x [6] Larkum A W D. High rates of nitrogen fixation on coral skeletons after predation by the crown of thorns starfish Acanthaster planci[J]. Marine Biology, 1988, 97(4): 503−506. doi: 10.1007/BF00391046 [7] Munday P L. Habitat loss, resource specialization, and extinction on coral reefs[J]. Global Change Biology, 2004, 10(10): 1642−1647. doi: 10.1111/j.1365-2486.2004.00839.x [8] Brodie J, Fabricius K, De’ath G, et al. Are increased nutrient inputs responsible for more outbreaks of crown-of-thorns starfish? An appraisal of the evidence[J]. Marine Pollution Bulletin, 2005, 51(1−4): 266−278. doi: 10.1016/j.marpolbul.2004.10.035 [9] Fabricius K E, Okaji K, De’ath G. Three lines of evidence to link outbreaks of the crown-of-thorns seastar Acanthaster planci to the release of larval food limitation[J]. Coral Reefs, 2010, 29(3): 593−605. doi: 10.1007/s00338-010-0628-z [10] 姚秋翠, 余克服, 廖芝衡, 等. 棘冠海星及其对珊瑚礁的生态影响研究进展[J]. 生态学报, 2022, doi: 10.5846/stxb202107312078.Yao Qiucui, Yu Kefu, Liao Zhiheng, et al. A review of research on crown-of-thorns starfish and their ecological effects on coral reefs[J]. Acta Ecologica Sinica, 2022, doi: 10.5846/stxb202107312078. [11] Keesing J K, Halford A R. Field measurement of survival rates of juvenile Acanthaster planci: techniques and preliminary results[J]. Marine Ecology Progress Series, 1992, 85(1/2): 107−114. [12] Ciarapica G, Passeri L. An overview of the maldivian coral reefs in Felidu and North Malé atoll (Indian Ocean): platform drowning by ecological crises[J]. Facies, 1993, 28(1): 33−65. doi: 10.1007/BF02539727 [13] Cowan Z L, Pratchett M, Messmer V, et al. Known predators of crown-of-thorns starfish (Acanthaster spp. ) and their role in mitigating, if not preventing, population outbreaks[J]. Diversity, 2017, 9(1): 7. doi: 10.3390/d9010007 [14] 邓华健. 渤海湾沉积物–水界面营养盐交换通量的研究[D]. 天津: 天津大学, 2004.Deng Huajian. The study on the exchange fluxes of nutrients at the sediment-water interface in Bohai Bay[D]. Tianjin: Tianjin University, 2004. [15] 方鑫. 海州湾海洋牧场沉积物–水界面营养盐交换特性及生物扰动作用的研究[D]. 上海: 上海海洋大学, 2018.Fang Xin. The exchange characteristics of nutrients and the bioturbation effects at the sediment-water interface in the marine ranching area of Haizhou Bay[D]. Shanghai: Shanghai Ocean University, 2018. [16] Biles C L, Paterson D M, Ford R B, et al. Bioturbation, ecosystem functioning and community structure[J]. Hydrology and Earth System Sciences, 2002, 6(6): 999−1005. doi: 10.5194/hess-6-999-2002 [17] 张小勇. 黄、东海陆架沉积物中氮、磷的形态分布及与浮游植物的关系[D]. 青岛: 中国海洋大学, 2013.Zhang Xiaoyong. The distribution of nitrogen, phosphorus forms and the relationship with the total phytoplankton in the Yellow Sea and the East China Sea continental shelf[D]. Qingdao: Ocean University of China, 2013. [18] Reckhardt A, Beck M, Seidel M, et al. Carbon, nutrient and trace metal cycling in sandy sediments: a comparison of high-energy beaches and backbarrier tidal flats[J]. Estuarine, Coastal and Shelf Science, 2015, 159: 1−14. doi: 10.1016/j.ecss.2015.03.025 [19] Furnas M, Alongi D, McKinnon D, et al. Regional-scale nitrogen and phosphorus budgets for the northern (14°S) and central (17°S) Great Barrier Reef shelf ecosystem[J]. Continental Shelf Research, 2011, 31(19/20): 1967−1990. [20] Ning Zhiming, Yu Kefu, Wang Yinghui, et al. Carbon and nutrient dynamics of permeable carbonate and silicate sands adjacent to coral reefs around Weizhou Island in the northern South China Sea[J]. Estuarine, Coastal and Shelf Science, 2019, 225: 106229. doi: 10.1016/j.ecss.2019.05.011 [21] 宋金明, 李鹏程. 南沙群岛海域沉积物–海水界面间营养物质的扩散通量[J]. 海洋科学, 1996(5): 43−50.Song Jinming, Li Pengcheng. Studies on characteristics of nutrient diffusion fluxes across sediment-water interface in the district of Nansha Islands, South China Sea[J]. Marine Sciences, 1996(5): 43−50. [22] 李元超, 吴钟解, 梁计林, 等. 近15年西沙群岛长棘海星暴发周期及暴发原因分析[J]. 科学通报, 2019, 64(33): 3478−3484.Li Yuanchao, Wu Zhongjie, Liang Jilin, et al. Analysis on the outbreak period and cause of Acanthaster planci in Xisha Islands in recent 15 years[J]. Chinese Science Bulletin, 2019, 64(33): 3478−3484. [23] Ning Zhiming, Liu Sumei, Zhang Guoling, et al. Impacts of an integrated multi-trophic aquaculture system on benthic nutrient fluxes: a case study in Sanggou Bay, China[J]. Aquaculture Environment Interactions, 2016, 8: 221−232. doi: 10.3354/aei00144 [24] Guo Jing, Yu Kefu, Wang Yinghui, et al. Potential impacts of anthropogenic nutrient enrichment on coral reefs in the South China Sea: evidence from nutrient and chlorophyll a levels in seawater[J]. Environmental Science: Processes & Impacts, 2019, 21(10): 1745−1753. [25] 陈露. 南沙、西沙群岛海域营养盐对浮游植物生长的影响[D]. 上海: 上海海洋大学, 2015.Chen Lu. Effects of nutrient on phytoplankton growth in the waters of the Nansha and Xisha Islands[D]. Shanghai: Shanghai Ocean University, 2015. [26] Heil C A, Revilla M, Glibert P M, et al. Nutrient quality drives differential phytoplankton community composition on the southwest Florida shelf[J]. Limnology and Oceanography, 2007, 52(3): 1067−1078. doi: 10.4319/lo.2007.52.3.1067 [27] Lucas J S. Quantitative studies of feeding and nutrition during larval development of the coral reef asteroid Acanthaster planci (L. )[J]. Journal of Experimental Marine Biology & Ecology, 1982, 65(2): 173−193. [28] Brainard R, Maragos J, Schroeder R, et al. The state of coral reef ecosystems of the U. S. Pacific remote island areas[C]. Honolulu: NOAA Technical Memorandum NOS NCCOS, 2005: 338–372. [29] Houk P, Bograd S, van Woesik R. The transition zone chlorophyll front can trigger Acanthaster planci outbreaks in the Pacific Ocean: historical confirmation[J]. Journal of Oceanography, 2007, 63(1): 149−154. doi: 10.1007/s10872-007-0013-x [30] 郑珍珍. 海洋氨氧化过程对温度的响应[D]. 厦门: 厦门大学, 2018.Zheng Zhenzhen. The thermal response of marine ammonia oxidation[D]. Xiamen: Xiamen University, 2018. [31] Daims H, Lebedeva E, Pjevac P, et al. Complete nitrification by Nitrospira bacteria[J]. Nature, 2015, 528(7583): 504−509. doi: 10.1038/nature16461 [32] Van Kessel M A H J, Speth D R, Albertsen M, et al. Complete nitrification by a single microorganism[J]. Nature, 2015, 528(7583): 555−559. doi: 10.1038/nature16459 [33] Smith J M, Chavez F P, Francis C A. Ammonium uptake by phytoplankton regulates nitrification in the sunlit ocean[J]. PLoS One, 2014, 9(9): e108173. doi: 10.1371/journal.pone.0108173 [34] Slomp C P, Malschaert J F P, van Raaphorst W. The role of adsorption in sediment-water exchange of phosphate in North Sea continental margin sediments[J]. Limnology and Oceanography, 1998, 43(5): 832−846. doi: 10.4319/lo.1998.43.5.0832 [35] 何其江, 刘刚, 王雪木, 等. 西沙群岛宣德环礁的精细水下地貌组合特征及其成因机制[J]. 海洋学报, 2021, 43(8): 81−92.He Qijiang, Liu Gang, Wang Xuemu, et al. Submarine geomorphologic features and genetic mechanism in the Xuande Atoll, Xisha Islands[J]. Haiyang Xuebao, 2021, 43(8): 81−92. [36] 李亮, 何其江, 龙根元, 等. 南海宣德海域表层沉积物粒度特征及其输运趋势[J]. 海洋地质与第四纪地质, 2017, 37(6): 140−148.Li Liang, He Qijiang, Long Genyuan, et al. Sediment grain size distribution pattern and transportation trend in the Xuande water, South China Sea[J]. Marine Geology and Quaternary Geology, 2017, 37(6): 140−148. [37] Wiedenmann J, D’Angelo C, Smith E G, et al. Nutrient enrichment can increase the susceptibility of reef corals to bleaching[J]. Nature Climate Change, 2013, 3(2): 160−164. doi: 10.1038/nclimate1661 [38] Ning Zhiming, Fang Cao, Yu Kefu, et al. Influences of phosphorus concentration and porewater advection on phosphorus dynamics in carbonate sands around the Weizhou Island, northern South China Sea[J]. Marine Pollution Bulletin, 2020, 160: 111668. doi: 10.1016/j.marpolbul.2020.111668 [39] Den Haan J, Huisman J, Brocke H J, et al. Nitrogen and phosphorus uptake rates of different species from a coral reef community after a nutrient pulse[J]. Scientific Reports, 2016, 6: 28821. doi: 10.1038/srep28821 [40] Chen Xiaoyan, Yu Kefu, Huang Xueyong, et al. Atmospheric nitrogen deposition increases the possibility of macroalgal dominance on remote coral reefs[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(5): 1355−1369. doi: 10.1029/2019JG005074 [41] Ning Xiuren, Chai Fei, Xue Huijie, et al. Physical-biological oceanographic coupling influencing phytoplankton and primary production in the South China Sea[J]. Journal of Geophysical Research: Oceans, 2004, 109(C10): C10005. doi: 10.1029/2004JC002365 [42] Furnas M, Mitchell A, Skuza M, et al. In the other 90%: phytoplankton responses to enhanced nutrient availability in the Great Barrier Reef Lagoon[J]. Marine Pollution Bulletin, 2005, 51(1/4): 253−265. 期刊类型引用(3)
1. 余骄洋, 俞小鹏, 余克服, 马玉玲. 西沙群岛太阳长棘海星(Acanthaster solaris)幽门盲囊细菌多样性及群落组成研究. 热带地理. 2025(06)  百度学术
百度学术2. 李渊,胡战彪,谢世君,刘世刚,妙星,王伟,肖家光,王芮,林龙山. 南海长棘海星物种有效性探讨. 应用海洋学学报. 2024(02): 201-207 .  百度学术
百度学术3. 王岚,魏皓,车亚辰,张翠翠. 融合类别数量自适应深度数据增强和迁移学习的造礁珊瑚识别方法研究. 海洋学报. 2024(09): 120-130 .  本站查看
本站查看其他类型引用(4)
-





 下载:
下载:
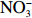
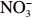
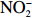
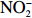
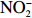
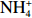
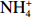
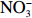
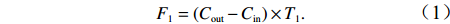
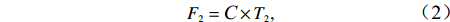
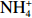
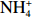

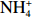
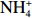
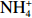
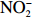
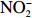
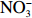
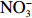
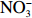
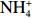
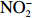
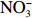

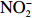
 下载:
下载:
 百度学术
百度学术


